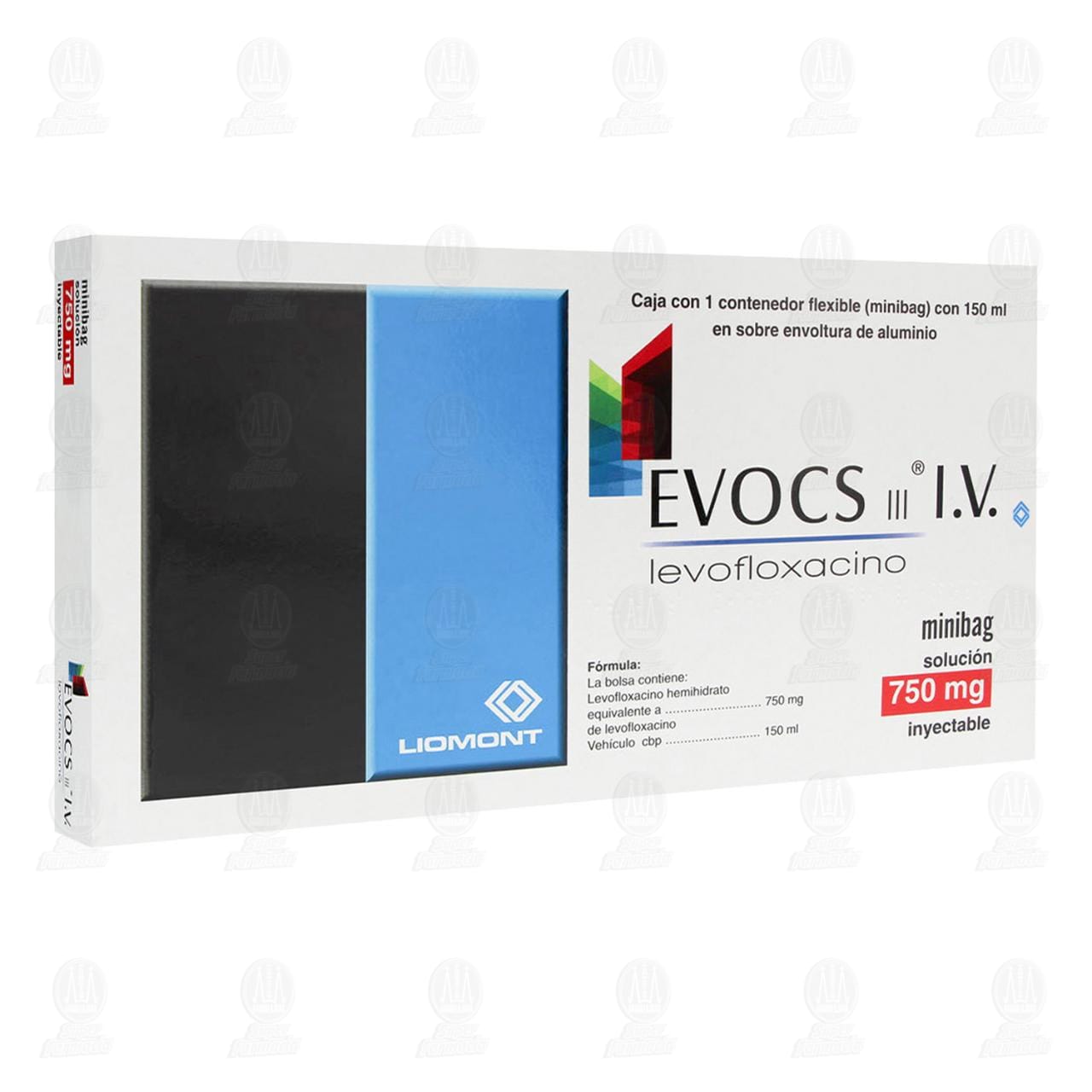
Evocs III 750 mg, Minibag Inyectable 150 ml.
Agregar a favoritos
Hola! Es necesario ingresar o crear tu cuenta, para agregar productos a favoritos
Evocs III 750 mg, Minibag Inyectable 150 ml.
- Precio exclusivo para venta online y pueden diferir de los precios en sucursal
- Los precios pueden variar dependiendo la zona geográfica
Controlado/antibiotico
En la venta de antibióticos se requiere receta médica que cumpla con lo requisitos legales vigentes y es necesario presentarla previamente. En medicamentos controlados es necesario receta médica junto con copia del INE correspondiente para que el pedido sea entregado.
Medicamento controlado
- En la venta de antibióticos se requiere receta médica que cumpla con lo requisitos legales vigentes y es necesario presentarla previamente. En medicamentos controlados es necesario receta médica junto con copia del INE correspondiente para que el pedido sea entregado.
- Al ser necesaria la recolección de receta este producto genera un costo adicional de $ 20.00
- La presente se considera para fines informativos sin describir características, beneficios o uso de los medicamentos. Esta información únicamente será destinada para exponer el precio de estos productos. Cualquier duda relacionada con sus características, propiedades y empleo deberá ser consultada con su médico
Para conocer la disponibilidad del producto ingresa tu código postal
FORMA FARMACÉUTICA Y FORMULACIÓN:
El frasco ámpula CONTIENE:
Levofloxacino hemihidrato equivalente a 500 mg
de levofloxacino
Vehículo, c.b.p. 20 mL.
La bolsa (Minibag) contiene:
Levofloxacino hemihidrato equivalente a 500 mg, 750 mg
de levofloxacino
Vehículo, c.b.p. 100 mL, 150 mL
INDICACIONES TERAPÉUTICAS: EVOCS-III® está indicado en el tratamiento de infecciones del tracto respiratorio superior e inferior, incluyendo sinusitis, exacerbación aguda de bronquitis crónica y neumonías adquiridas en la comunidad. Infecciones de la piel y sus estructuras como: impétigo, abscesos, furunculosis, celulitis y erisipelas. Infecciones del tracto urinario incluyendo pielonefritis aguda. También, está indicado en el tratamiento de osteomielitis.
EVOCS-III® está indicado principalmente en infecciones de las siguientes bacterias en las cuales la eficacia clínica ha sido demostrada:
Bacterias aeróbicas gram (+): Enterococcus (Streptococcus) faecalis, Staphylococcus aureus, Staphylococcus epidermidis, Staphylococcus saprophyticus, Streptococcus agalactiae, Streptococcus pneumoniae (incluyendo S. pneumoniae, penicilina y macrólido-resistente), Streptococcus pyogenes.
Bacterias aeróbicas gram (-): Citrobacter freundii Enterobacter cloacae, Escherichia coli, Haemophilus influenzae, Haemophilus parainfluenzae, Klebsiella oxytoca, Klebsiella pneumoniae, Legionella pneumophilia, Moraxella (Branhamella) catarrhalis, Proteus mirabilis, Pseudomonas aeruginosa.
Otros microorganismos: Chlamydia pneumoniae, Mycoplasma pneumoniae.
CONTRAINDICACIONES: Hipersensibilidad a levofloxacino, otras quinolonas o algún componente de este producto. Embarazo, lactancia y en menores de 18 años.
RESTRICCIONES DE USO DURANTE EL EMBARAZO Y LA LACTANCIA: No se use durante el embarazo ni la lactancia. No existen estudios adecuados y bien controlados en mujeres embarazadas. EVOCS-III® podría ser usado durante el embarazo sólo si el beneficio potencial justifica el riesgo potencial al feto.
Debido al potencial de reacciones adversas serias en lactantes de madres que toman EVOCS-III®, deberá tomarse una decisión para discontinuar la lactancia o discontinuar el fármaco, tomando en cuenta la importancia del fármaco para la madre. No se ha establecido la seguridad y eficacia en niños y adolescentes en etapa de crecimiento. Se ha observado que las quinolonas pueden producir erosión en las articulaciones de carga y otros signos de artropatía en animales inmaduros de varias especies.
REACCIONES SECUNDARIAS Y ADVERSAS: Levofloxacino es generalmente bien tolerado. En pruebas que involucraron 3865 pacientes, la incidencia de experiencias adversas relacionadas a levofloxacino fue de 6.2%, de la cual fue 2.3% menor que la experimentada con los agentes de comparación acumulados.
Los eventos adversos más comunes (1%) considerados por los investigadores como probables o definitivamente relacionados al fármaco fueron: Diarrea, náuseas.
Otros eventos adversos relacionados al fármaco observados en 0.3 a < 1% de la población en estudio fueron: Flatulencia, dolor abdominal, prurito, rash, dispepsia, insomnio, mareo y vaginitis.
Eventos adversos reportados adicionalmente por la experiencia mundial post-comercialización con EVOCS-III® incluyen: Neumonitis alérgica, choque anafiláctico, reacción anafiláctica, disfonía, EEG anormal, encefalopatía, eosinofilia, eritema multiforme, anemia hemolítica, falla orgánica multisistémica, palpitaciones, parestesia, prolongación del tiempo de protrombina, síndrome de Stevens-Johnson, ruptura de tendón, vasodilatación.
PRECAUCIONES EN RELACIÓN CON EFECTOS DE CARCINOGÉNESIS, MUTAGÉNESIS, TERATOGÉNESIS Y SOBRE LA FERTILIDAD:
Carcinogenicidad: EVOCS-III® no exhibió potencial carcinogénico cuando se probó, ya fuere en bioensayo con ratas de 2 años o el modelo de carcinogénesis de órganos múltiples en dos etapas.
Toxicidad especial: Así como con otras quinolonas, levofloxacino ha mostrado causar artropatía en animales inmaduros. En perros inmaduros (4-5 meses de edad) dosis orales de 10 mg/kg/día por 7 días y dosis intravenosa de 4 mg/kg/día por 14 días ocasionan lesiones artropáticas.
Dosis orales de 300 mg/kg/día por 7 días y dosis intravenosas de 60 mg/kg/día por 4 semanas producen artropatía en ratas jóvenes. Levofloxacino muestra fototoxicidad similar en magnitud a la ofloxacina en bioensayo de la protuberancia en la oreja de ratón. Mientras que se ha observado cristaluria en algunos estudios intravenosos en ratas, los cristales están presentes sólo después de la micción y no están asociados con nefrotoxicidad. En ratones, el efecto estimulador en el SNC de las quinolonas es incrementado por la administración concomitante de fármacos antiinflamatorios no esteroides como fenbufén.
En perros, levofloxacino administrado en 6 mg/kg a más alta por inyección intravenosa rápida produce efectos hipotensivos los cuales se consideran relacionados con la liberación de histamina.
Mutagenicidad: Levofloxacino no fue mutagénico en la mutación bacteriana, mutación CHO/HGPRT, micronúcleos, letal dominante, síntesis no programada de DNA (in vivo), y el ensayo de intercambio in vivo de cromátides hermanas (SCE).
Fue positivo en la prueba de aberración cromosómica in vitro y ensayos SCE.
Toxicidad en la reproducción: Levofloxacino no causó daño de la fertilidad o desarrollo reproductivo en ratas con dosis orales tan altas como 360 mg/kg/día y dosis intravenosas tan altas como 100 mg/kg/día.
EVOCS-III® no fue teratogénico en ratas con dosis orales tan altas como 810 mg/kg/día o dosis intravenosas tan altas como 160 mg/kg/día. No se observó teratogenicidad en conejos a dosis orales tan altas como 50 mg/kg/día o con dosis intravenosas tan altas como 25 mg/kg/día. La administración oral de 810 mg/kg/día causó disminución de peso del feto e incrementó la mortalidad fetal.
INTERACCIONES MEDICAMENTOSAS Y DE OTRO GÉNERO:
Vía intravenosa únicamente:
Antiácidos orales, sucralfato, cationes metálicos o multivitaminas: No hay datos concernientes a la interacción de quinolonas por vía intravenosa. Sin embargo, las quinolonas no deben ser coadministradas con ninguna solución que contenga cationes multivalentes, ej. magnesio, a través de la misma línea intravenosa.
Al igual que otras quinolonas, la administración concomitante de levofloxacino puede prolongar la vida media de teofilina, elevar los niveles séricos de teofilina, e incrementar el riesgo de reacciones adversas relacionadas a la teofilina en la población de pacientes. Por lo tanto, los niveles de teofilina deben ser estrechamente monitoreados y puede ajustarse la dosis de teofilina, si fuese apropiado cuando levofloxacino sea coadministrado. Las reacciones adversas, incluyendo convulsiones, pueden ocurrir con o sin elevación de los niveles séricos de teofilina.
No se detectó un efecto significativo de levofloxacino en las concentraciones en plasma, AUC y disposición de otros parámetros por teofilina en un estudio clínico que involucra 14 voluntarios sanos. De manera similar, no se observaron efectos aparentes de teofilina en la absorción y disposición de levofloxacino.
La administración concomitante de levofloxacino con digoxina y ciclosporina no requieren de modificación en la dosis de uno u otro compuesto. Sin embargo, los niveles de digoxina pueden ser estrechamente monitoreados en pacientes que reciben terapia concomitante con digoxina.
Ciertas quinolonas incluyendo levofloxacino pueden aumentar los efectos anticoagulantes de la warfarina oral o sus derivados. Cuando estos productos son administrados concomitantemente, el tiempo de protrombina u otras pruebas de coagulación deben ser monitoreadas estrechamente, especialmente en pacientes ancianos.
Levofloxacino se puede administrar con seguridad a individuos que reciben concomitantemente terapia con probenecid o cimetidina, ambos disminuyen la depuración y prolongan la vida media de levofloxacino, siempre y cuando la dosis de Levofloxacino sea ajustada apropiadamente basada en la función renal del paciente.
La administración concomitante de fármacos antiinflamatorios no esteroides con una quinolona, incluyendo levofloxacino, puede incrementar el riesgo de estimulación del SNC y crisis convulsivas. Se han reportado alteraciones en la glucosa sanguínea, incluyendo hiperglucemia e hipoglucemia en pacientes tratados concomitantemente con quinolonas y agentes antidiabéticos. Por lo tanto, se recomienda monitoreo cuidadoso de la glucosa sanguínea cuando estos agentes son coadministrados.
La absorción de levofloxacino y disposición en sujetos HIV-infectados con o sin tratamiento concomitante con zidovudina fueron similares. Por lo tanto, no se ajusta la dosis para levofloxacino al ser requerida cuando se coadministra con zidovudina. El efecto de levofloxacino en la farmacocinética de zidovudina no se ha estudiado.
PRECAUCIONES GENERALES: Se ha reportado hipersensibilidad seria y ocasionalmente fatal y/o reacciones anafilácticas en pacientes que reciben terapia con quinolonas. Estas reacciones a menudo ocurren seguidas de la primera dosis. Algunas reacciones fueron acompañadas de colapso cardiovascular, hipotensión/shock, convulsiones, pérdida de conciencia, hormigueo, angioedema, obstrucción del conducto aéreo, disnea, urticaria, comezón, y otras reacciones serias de la piel, levofloxacino debe ser discontinuado inmediatamente a la primera aparición de erupción en la piel o cualquier otro signo de hipersensibilidad.
Algunos eventos serios y fatales debidos a mecanismos inmunológicos no conocidos, se han reportado en pacientes que reciben terapia con quinolonas, incluyendo raras veces levofloxacino. Estos eventos pueden ser severos y generalmente ocurren después de la administración de dosis múltiples. Las manifestaciones clínicas pueden incluir una o más de las siguientes: fiebre, rash, o reacciones dermatológicas severas, vasculitis, artralgia, mialgia, enfermedad del suero, náuseas, neumonitis alérgica, nefritis intersticial, insuficiencia o falla renal aguda, hepatitis, ictericia, falla o necrosis hepática aguda, anemia incluyendo hemolítica y aplásica, trombocitopenia, leucopenia, agranulocitosis, pancitopenia, y/u otras anormalidades hematológicas. El fármaco podría ser discontinuado inmediatamente a la primera aparición de erupción en la piel o cualquier otro signo de hipersensibilidad y se han reportado convulsiones y psicosis tóxica en pacientes que recibieron quinolonas incluyendo levofloxacino.
Las quinolonas pueden también causar incremento de la presión intracraneal y estimulación del SNC, lo cual puede conducir a temblores, inquietud, ansiedad, aturdimiento, confusión, alucinaciones, paranoia, depresión, pesadillas, insomnio y rara vez idea o actos suicidas.
Estas reacciones pueden ocurrir después de la primera dosis. Si las reacciones aparecen en pacientes que están recibiendo levofloxacino, el fármaco debe ser discontinuado e implementar medidas apropiadas. Al igual que las quinolonas, levofloxacino debe ser usado con precaución en pacientes con sospecha conocida de desórdenes de SNC que puedan predisponer a convulsiones o disminuir el umbral convulsivo (ejemplo: arteriosclerosis cerebral severa, epilepsia) o en presencia de otros factores de riesgo que puedan predisponer a convulsiones o disminuir el umbral convulsivo (por ejemplo, ciertas terapias, disfunción renal).
Se ha reportado colitis seudomembranosa con todos los agentes antibacterianos incluyendo levofloxacino y puede variar de severidad desde leve a poner en peligro la vida. Por lo tanto, es importante considerar este diagnóstico en pacientes que presentan diarrea subsecuente a la administración de cualquier agente antibacteriano.
El tratamiento con agentes antibacterianos altera la flora normal del colon y puede permitir sobrecrecimiento de clostridia. Algunos estudios indican que una toxina producida por Clostridium difficile es una de las principales causas de colitis asociada a antibióticos.
Se ha reportado ruptura de tendones en hombros, manos y tendones de Aquiles que han requerido cirugía o han provocado inestabilidad por tiempos prolongados, en pacientes que han recibido quinolonas. Levofloxacino debe ser discontinuado si el paciente experimenta dolor, inflamación o ruptura de un tendón. levofloxacino debe ser usado con precaución en pacientes con insuficiencia renal. En pacientes con deficiente función renal, ajustar la dosis si es necesario para evitar la acumulación de levofloxacino debido a la disminución de depuración.
Se han observado reacciones de fototoxicidad moderada a severa en pacientes expuestos directamente a la luz mientras reciben terapia con quinolonas. Si ocurriera fototoxicidad el tratamiento debe ser discontinuado.
Al igual que otras quinolonas, se han reportado alteraciones en la glucosa, comúnmente en pacientes diabéticos que reciben tratamiento concomitante con agentes hipoglucémicos orales o con insulina. En estos pacientes se recomienda monitorear cuidadosamente la glucosa en sangre. Si ocurriera una reacción hipoglucémica, el tratamiento con levofloxacino debe ser discontinuado. Aunque la cristaluria no se ha reportado en ensayos clínicos con levofloxacino, se debe mantener una adecuada hidratación para prevenir la formación de altas concentraciones en orina.
Vía intravenosa: Debido a que una inyección rápida o bolo intravenoso puede provocar hipotensión, EVOCS-III® sólo debe ser administrado por infusión intravenosa lenta en un periodo no menor a 60 minutos.
Efectos en la habilidad de manejo y uso de máquinas: Pueden ocurrir efectos adversos neurológicos como mareos y aturdimientos. Por lo tanto, los pacientes deben conocer estas reacciones al EVOCS-III® antes de operar maquinaria o automóviles, o realizar otras actividades que requieren coordinación y alerta mental.
DOSIS Y VÍA DE ADMINISTRACIÓN:
Vía intravenosa: EVOCS-III® sólo debe ser administrado por infusión intravenosa, no por administración intramuscular, intraperitoneal o subcutánea (véase Instructivo anexo).
Precaución: Debe evitarse una rápida infusión o bolo intravenoso.
EVOCS-III® debe administrarse en infusión intravenosa, lentamente en un periodo no menor a 60 minutos. La dosis usual para adultos de EVOCS-III® es 500 mg administrada por infusión lenta cada 24 horas siguiendo el esquema de dosificación.
Esquema de dosificación:
Pacientes con función renal normal
|
Infección |
Dosis |
Frecuencia |
Duración |
|
Exacerbación de bronquitis crónica |
500 mg |
c/24 h |
5-7 días |
|
Neumonía adquirida en la comunidad |
500 mg |
c/24 h |
7-14 días |
|
Sinusitis |
500 mg |
c/24 h |
10-14 días |
|
Infecciones de piel y tejidos blandos |
500 mg |
c/24 h |
7-10 días |
|
Pielonefritis aguda e ITU |
250 mg |
c/24 h |
10 días |
|
Osteomielitis |
500 mg |
c/24 h |
6-12 semanas |
Pacientes con insuficiencia renal
|
Estatus renal |
Dosis inicial |
Dosis subsecuente |
|
Infecciones respiratorias agudas/SSSI/Osteomielitis |
||
|
CCr de 20 a 49 ml/min |
500 mg |
250 mg c/24 horas |
|
CCr de 10 a 19 ml/min |
500 mg |
250 mg c/48 horas |
|
Hemodiálisis |
500 mg |
250 mg c/48 horas |
|
D P C A |
500 mg |
250 mg c/48 horas |
|
Pielonefritis aguda/ITU |
||
|
CCr ≥ 20 ml/min |
No requiere ajuste de dosis |
|
|
CCr de 10 a 19 ml/min |
250 mg |
|
CCr = Depuración de creatinina.
DPCA = Diálisis peritoneal crónica ambulatoria.
ITU = Infecciones del tracto urinario.
EVOCS-III® I.V. (solución inyectable premezclada en solución de dextrosa al 5%, dosis única en contenedor flexible).
EVOCS-III® I.V. está provisto en contenedores flexibles que contienen una premezcla lista para usarse en solución de EVOCS-III® en solución de dextrosa al 5% para uso único. El volumen de llenado es 100 ml. No es necesaria una dilución adicional para esta preparación. Cada 100 ml de premezcla en contenedor flexible lista, contiene solución diluida con un equivalente a 500 mg de EVOCS-III® (5 mg/ml) en solución de dextrosa al 5%.
Dado que este producto no contiene agentes preservativos o bacteriostáticos, se debe seguir una técnica aséptica en la preparación de la solución parenteral final.
Debido a que las ampolletas y los contenedores flexibles son para dosis única, cualquier porción remanente en el contenedor se debe descartar. Cuando son usadas dosis divididas, el contenido completo debe ser secado inmediatamente usando un procedimiento de entrada única y la segunda dosis debe ser preparada y almacenada para uso subsecuente.
Existe información limitada disponible sobre la compatibilidad de EVOCS-III® con otros fármacos intravenosos, no se deben adicionar aditivos u otros medicamentos a EVOCS-III® en contenedores flexibles o administrar simultáneamente en la misma línea intravenosa. Si se emplea la misma línea intravenosa para infusión secuencial de diferentes fármacos, la línea debe ser drenada antes y después de la infusión de EVOCS-III® con solución compatible con levofloxacino y con los fármacos administrados en la misma línea.
INSTRUCCIONES PARA EVOCS-III® en frasco ámpula:
La solución para infusión de EVOCS-III® debe ser administrada una o dos veces al día. El tiempo de infusión debe ser de no porlo menos 60 minutos. EVOCS-III® es compatible con solución de cloruro de sodio al 0.9%, solución de dextrosa al 5%, solución Ringer en dextrosa al 2.5%, y combinaciones para nutrición parenteral (aminoácidos carbohidratos, electrolitos).
No debe mezclarse con heparina o soluciones alcalinas (por ejemplo, carbonato ácido de sodio). La solución para infusión debe usarse dentro de las primeras 3 horas con objeto de prevenir alguna contaminación bacteriana.
Instrucciones para EVOCS-III® en contenedor flexible Minibag:
Para abrir:
1. Quite la envoltura exterior hasta la muesca y remueva el contenedor de la solución.
2. Cheque si el contenedor tiene fuga apretando la bolsa firmemente. Si encuentra una fuga o si el sello no está intacto, descarte la solución, ya que la esterilidad podría haberse afectado.
3. No se use si la solución es turbia o si existe algún precipitado.
4. Use equipo estéril.
5. Precaución: No use contenedores flexibles en conexiones en serie. Podría resultar un embolismo debido al aire residual absorbido del contenedor primario antes de que se complete la administración del fluido del contenedor secundario.
Preparación para la administración:
1. Cierre la llave controladora de flujo del equipo de administración.
2. Remueva la cubierta desde el inicio hasta el último punto del contenedor.
3. Inserte la aguja del equipo de administración en el puerto, enroscando hasta que la aguja quede firmemente asentada.
4. Coloque el contenedor en el soporte.
5. Oprima y deje caer gotas, para establecer un apropiado nivel de fluido en la cámara durante la infusión de EVOCS-III® Minibag.
6. Abra la llave controladora de flujo para eliminar el aire del equipo. Cierre la llave.
7. Regule la velocidad de administración con la llave controladora de flujo.
MANIFESTACIONES Y MANEJO DE LA SOBREDOSIFICACIÓN O INGESTA ACCIDENTAL: En caso de una sobredosis aguda y si la ingestión es reciente, el estómago debe ser vaciado. El paciente debe ser observado y se debe mantener una adecuada hidratación.
EVOCS-III® no es eficientemente removido por hemodiálisis o por diálisis peritoneal.
PRESENTACIONES:
Solución inyectable: Caja con frasco ámpula con 20 ml de solución.
Solución inyectable Minibag: 1, 3 y 5 contenedores flexibles con capacidad de 100 mL con 500 mg de levofloxacino en solución de dextrosa al 5% protegida por una sobre-envoltura de Aluminio (con o sin caja).
1, 3 y 5 contenedores flexibles con capacidad de 150 mL con 750 mg de levofloxacino en solución de dextrosa al 5% protegida por una sobre-envoltura de aluminio (con o sin caja).
RECOMENDACIONES SOBRE ALMACENAMIENTO: Consérvese a temperatura ambiente a no más de 30°C. Protéjase de la luz.
LEYENDAS DE PROTECCIÓN:
Su venta requiere receta médica. No se deje al alcance de los niños. No se administre a menores de 18 años ni a mujeres en periodo de lactancia. La solución debe administrarse intravenosamente en un periodo no menor a 60 minutos. No se administre si la solución no es transparente, si contiene partículas en suspensión o sedimento y/o si el cierre o el envase han sido violados. Envase de uso único. Si no se administra todo el producto, deséchese el sobrante.
Reporte las sospechas de reacción adversa al correo: farmacovigilancia@cofepris.gob.mx y
farmacovigilancia@liomont.com.mx
Hecho en México por:
Baxter, S.A. de C.V.
Av. de los 50 metros No. 2 CIVAC,
C.P. 62500, Jiutepec, Morelos, México
Para:
LABORATORIOS LIOMONT, S.A. de C.V.
Adolfo López Mateos No. 68, Col. Cuajimalpa,
C.P. 05000, Deleg. Cuajimalma de Morelos,
D.F., México
Reg. Núm. 382M2007, SSA IV