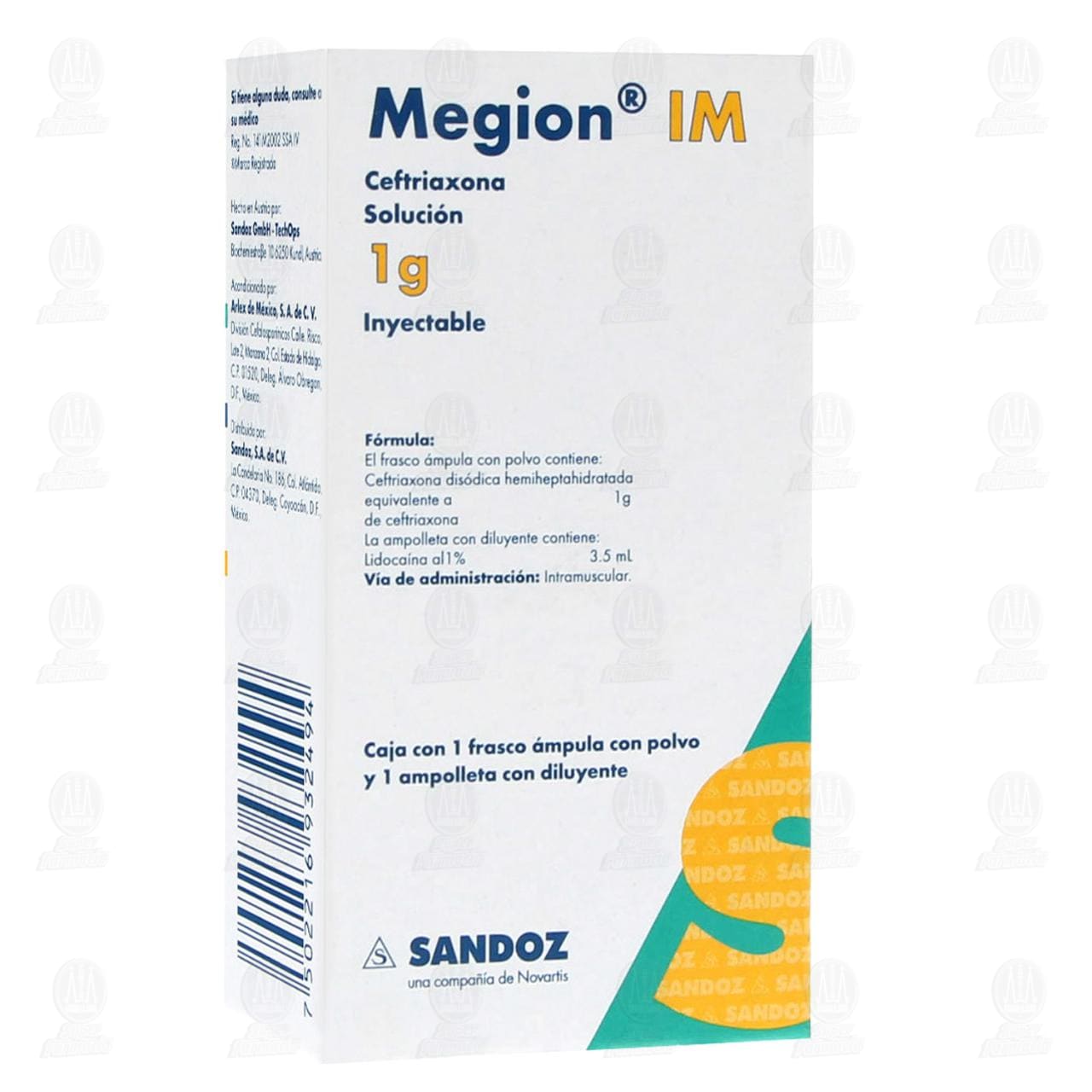
Megion IM Solución Inyectable, 1gr/3.5ml.
Agregar a favoritos
Hola! Es necesario ingresar o crear tu cuenta, para agregar productos a favoritos
Megion IM Solución Inyectable, 1gr/3.5ml.
- Precio exclusivo para venta online y pueden diferir de los precios en sucursal
- Los precios pueden variar dependiendo la zona geográfica
Controlado/antibiotico
La venta de este medicamento requiere receta médica que cumpla con los requisitos legales vigentes y es necesario presentarla previamente para que el pedido sea entregado.
Medicamento controlado
- La venta de este medicamento requiere receta médica que cumpla con los requisitos legales vigentes y es necesario presentarla previamente para que el pedido sea entregado.
- Al ser necesaria la recolección de receta este producto genera un costo adicional de $ 20.00
- La presente se considera para fines informativos sin describir características, beneficios o uso de los medicamentos. Esta información únicamente será destinada para exponer el precio de estos productos. Cualquier duda relacionada con sus características, propiedades y empleo deberá ser consultada con su médico
Para conocer la disponibilidad del producto ingresa tu código postal
FORMA FARMACÉUTICA Y FORMULACIÓN:
El frasco con polvo contiene:
Ceftriaxona sódica hemiheptahidratada equivalente a 500 mg o 1 g
de Ceftriaxona
La ampolleta con diluyente contiene:
Lidocaína al 1% 3.5 mL
INDICACIONES TERAPÉUTICAS: MEGION® IM está indicado para el tratamiento de infecciones cuando se conoce o es probable que se deban a microorganismos que son sensibles a la ceftriaxona (Véase Farmacocinética y Farmacodinamia), por ejemplo:
Sepsis.
Meningitis bacteriana.
Infecciones abdominales (peritonitis, infecciones de los conductos biliares, así como del tracto gastrointestinal). La Ceftriaxona deberá usarse en combinación con antibióticos que puedan proporcionar cobertura anaeróbica.
Infecciones de la piel y de tejidos blandos.
Infecciones óseas y articulares.
Profilaxis perioperatoria de las infecciones.
Infecciones en pacientes con sistema inmunológico deprimido.
Infecciones renales y de las vías urinarias.
Infecciones de los conductos respiratorios, en especial neumonías, así como también infecciones de la faringe, nariz y oído.
Gonorrea.
Pacientes con manifestaciones de la enfermedad de Lyme (Etapas II y III).
MEGION® IM puede utilizarse solo o en combinación con otros agentes antibacterianos en la profilaxis de infecciones postoperatorias asociadas con cirugía cardiovascular o procedimientos urológicos, y en cirugía colorrectal. En la cirugía colorrectal, la ceftriaxona debe utilizarse en combinación con otro antibiótico que proporcione cobertura anaeróbica.
CONTRAINDICACIONES: Hipersensibilidad a ceftriaxona, o a cualquier otra cefalosporina, o a cualquiera de los excipientes.
Antecedentes de hipersensibilidad grave (por ejemplo, reacción anafiláctica) a cualquier otro tipo de agente antibacteriano beta-lactámico (penicilinas, monobactámicos y carbapenemas).
Ceftriaxona está contraindicada en: Recién nacidos prematuros hasta una edad postmenstrual de 41 semanas (edad gestacional + edad cronológica)*.
Recién nacidos de término completo (hasta 28 días de edad):
– Con hiperbilirubinemia, ictericia, o quienes son hipoalbuminémicos o acidóticos debido a que estas son condiciones en las cuales la unión a bilirrubina esté probablemente deteriorada*.
* Estudios in vitro han mostrado que ceftriaxona puede desplazar a la bilirrubina de los sitios de unión de albumina en suero, lo que lleva a un posible riesgo de encefalopatía por bilirrubina en estos pacientes.
Las contraindicaciones a lidocaína deben ser excluidas antes de la inyección intramuscular de ceftriaxona cuando la solución de lidocaína es utilizada como un solvente (véase Precauciones generales). Véase la información en el Resumen de Características del Producto de la lidocaína, especialmente las contraindicaciones.
Las soluciones de ceftriaxona que contienen lidocaína nunca deberán ser administradas por vía intravenosa.
RESTRICCIONES DE USO DURANTE EL EMBARAZO Y LA LACTANCIA:
Embarazo: La ceftriaxona atraviesa la barrera placentaria. Existen cantidades limitadas de datos sobre el uso de ceftriaxona en mujeres embarazadas. Estudios en animales no indican efectos dañinos directos o indirectos con respecto al desarrollo embrional/fetal, perinatal y postnatal (véase Farmacocinética y Farmacodinamia). Ceftriaxona sólo debería ser administrada durante el embarazo y en particular en el primer trimestre de embarazo si el beneficio es mayor que el riesgo.
Lactancia: Ceftriaxona es excretada a través de la leche humana en bajas concentraciones, pero en dosis terapéuticas no se prevé ningún efecto en los lactantes. Sin embargo, el riesgo de diarrea y micosis de las membranas mucosas no puede ser excluido. La posibilidad de sensibilización debería ser tomada en cuenta. Se debe tomar una decisión si descontinuar la lactancia o abstenerse/interrumpir la terapia con ceftriaxona, tomando en cuenta el beneficio de la lactancia para el niño y el beneficio de la terapia para la mujer.
Fertilidad: Estudios reproductivos no han mostrado evidencia de efectos adversos en la fertilidad de pacientes del género masculino o femenino.
REACCIONES SECUNDARIAS Y ADVERSAS: Las reacciones adversas frecuentemente más reportadas para ceftriaxona son eosinofilia, leucopenia, trombocitopenia, diarrea, erupción cutánea e incremento de enzimas hepáticas.
Los datos para determinar la frecuencia de Reacciones Adversas al Fármaco (RAF) de ceftriaxona se derivaron de estudios clínicos.
La siguiente convención ha sido utilizada para la clasificación de la frecuencia:
Muy común (≥ 1/10).
Común (≥ 1/100-< 1/10).
No común (≥ 1/1000-< 1/100).
Raro (≥ 1/10000-< 1/1000).
No conocido: (no puede ser estimado a partir de los datos disponibles).
Infecciones e infestaciones:
No común: infección micótica genital.
Raro: colitis pseudomembranosab.
No conocido: superinfecciónb.
Trastornos de la sangre y del sistema linfático:
Común: eosinofilia, leucopenia, trombocitopenia.
No común: granulocitopenia, anemia, coagulopatía.
No conocido: anemia hemolíticab, agranulocitosis.
Trastornos del sistema inmune:
No conocido: choque anafiláctico, reacción anafiláctica, reacción anafilactoide, hipersensibilidadb.
Trastornos del sistema nervioso:
No común: cefalea, mareo.
No conocido: convulsiones.
Trastornos del oído y del laberinto:
No conocido: vértigo.
Trastornos respiratorios, torácicos y mediastinales:
Raro: broncoespasmos.
Trastornos gastrointestinales:
Común: diarreab, heces blandas.
No común: náusea, vómito.
No conocido: pancreatitisb, estomatitis, glositis.
Trastornos hepatobiliares:
Común: incremento de enzimas hepáticas.
No conocido: precipitaciones vesicularesb, kernicterus.
Trastornos de piel y tejido subcutáneo:
Común: erupción cutánea.
No común: prurito.
Raro: urticaria.
No conocido: síndrome de Stevens Johnsonb, necrólisis epidermal tóxicab, eritema multiforme, pustulosis exantematosa generalizada aguda.
Trastornos renales y urinarios:
Raro: hematuria, glicosuria.
No conocido: oliguria, precipitación renal (reversible).
Trastornos generales y condiciones del sitio de administración:
No común: dolor en el sitio de inyección, pirexia.
Raro: edema, escalofríos.
Investigaciones:
No común: incremento de creatinina en sangre.
No conocido: prueba de Coombs con positivos falsosb, prueba de galactosemia con positivos falsosb, métodos no enzimáticos para la determinación de glucosa con resultados falsos positivosb.
a Con base en los reportes posteriores a la comercialización. Dado que estas reacciones son reportadas voluntariamente a partir de una población de tamaño incierto, no es posible estimar de manera confiable su frecuencia, la cual es por lo tanto categorizada como no conocida.
b Véase Precauciones generales.
Infecciones e infestaciones: Los reportes de diarrea después del uso de ceftriaxona pueden estar asociados con Clostridium difficile. El manejo apropiado de líquidos y electrólitos debería ser instituido (véase Precauciones generales).
PRECAUCIONES EN RELACIÓN CON EFECTOS DE CARCINOGÉNESIS, MUTAGÉNESIS, TERATOGÉNESIS Y SOBRE LA FERTILIDAD: Existe evidencia de estudios en animales que altas dosis de sal de ceftriaxona-calcio lleva a la formación de concreciones y precipitados en la vesícula biliar de perros y monos, lo cual ha probado ser reversible. Los estudios en animales no produjeron evidencia de toxicidad a la reproducción y genotoxicidad. No se realizaron estudios de carcinogenicidad con ceftriaxona.
INTERACCIONES MEDICAMENTOSAS Y DE OTRO GÉNERO: El uso concomitante con anticoagulantes orales puede incrementar el efecto anti-vitamina K y el riesgo de sangrado. Se recomienda que el Índice Internacional Normalizado (INR) se supervise frecuentemente y se ajuste la posología del fármaco anti-vitamina K en concordancia, tanto durante el tratamiento con ceftriaxona, como después de éste (véase Reacciones secundarias y adversas).
Existe evidencia contradictoria respecto al incremento potencial en toxicidad renal de los aminoglucósidos cuando se utilizan con cefalosporinas. En tales casos se debe cumplir estrictamente el monitoreo recomendado de las concentraciones de aminoglucósidos (y la función renal) en la práctica médica.
En un estudio in vitro, han sido observados efectos antagónicos con la combinación de cloranfenicol y ceftriaxona. La relevancia clínica de este hallazgo es desconocida.
Han habido reportes de una interacción entre ceftriaxona y productos orales que contienen calcio o interacción entre ceftriaxona intramuscular y productos que contienen calcio (vía intravenosa u oral).
En pacientes tratados con ceftriaxona, la prueba de Coombs puede arrojar resultados falsos positivos.
Ceftriaxona, como otros antibióticos, puede resultar en pruebas con falsos positivos para galactosemia.
Igualmente, los métodos no enzimáticos para la determinación de glucosa en la orina durante la terapia con ceftriaxona pueden producir resultados positivos falsos. Por esta razón, la determinación del nivel de glucosa en orina durante la terapia con ceftriaxona debería ser llevada a cabo enzimáticamente.
No se ha observado insuficiencia de la función renal después de la administración concurrente de grandes dosis de ceftriaxona y diuréticos potentes (por ejemplo, furosemida).
La administración simultánea de probenecid no reduce la eliminación de ceftriaxona.
Con base en reportes de la literatura la ceftriaxona es incompatible con amsacrina, vancomicina, fluconazol, aminoglucósidos y labetalol.
No utilizar diluyentes que contengan calcio, como la solución de Ringer o la solución de Hartmann para reconstituir la ceftriaxona. Puede haber formación de partículas.
PRECAUCIONES GENERALES:
Reacciones de hipersensibilidad: Como con todos los agentes antibacterianos beta-lactámicos, las reacciones de hipersensibilidad graves, y ocasionalmente fatales, han sido reportadas (véase Reacciones secundarias y adversas). En caso de reacciones de hipersensibilidad grave, el tratamiento con ceftriaxona debe ser descontinuado inmediatamente y se deben iniciar medidas de emergencia adecuadas. Antes del inicio del tratamiento, se debería establecer si el paciente tiene antecedentes de reacciones de hipersensibilidad grave a ceftriaxona u otras cefalosporinas, o cualquier otro tipo de agente beta-lactámico. Se debe tener precaución si ceftriaxona es proporcionada a pacientes con antecedentes de hipersensibilidad no grave a otros agentes beta-lactámicos.
Reacciones cutáneas adversas severas: (Síndrome de Stevens-Johnson o síndrome de Lyell/necrólisis epidérmica tóxica) han sido reportados; sin embargo, la frecuencia de estos eventos no es conocida (véase Reacciones secundarias y adversas).
Población pediátrica: La seguridad y la efectividad de ceftriaxona en recién nacidos, infantes y niños se estableció para las dosis descritas en posología y método de administración (véase Dosis y vía de administración). Los estudios han mostrado que ceftriaxona, como algunas otras cefalosporinas, puede desplazar la bilirrubina de la albúmina en suero.
Ceftriaxona está contraindicada en neonatos prematuros y de término completo en riesgo de desarrollar encefalopatía por hiperbilirrubinemia (véase Contraindicaciones).
Anemia hemolítica mediada por el sistema inmune: Se ha observado una anemia hemolítica mediada por el sistema inmune en pacientes que reciben agentes antibacterianos cefalosporínicos, incluyendo ceftriaxona (véase Reacciones secundarias y adversas). Casos graves de anemia hemolítica, incluyendo fatalidades, han sido reportados durante el tratamiento con ceftriaxona, tanto en adultos como en niños.
Si un paciente desarrolla anemia mientras recibe ceftriaxona, el diagnóstico de una anemia asociada con cefalosporina debería ser considerado e interrumpir ceftriaxona hasta que la etiología sea determinada.
Tratamiento a largo plazo: Durante un tratamiento prolongado, se debería realizar un recuento celular de sangre total en intervalos regulares.
Colitis/Sobrecrecimiento de microorganismos no susceptibles: La colitis asociada con agentes antibacterianos y la colitis pseudomembranosa han sido reportadas con casi todos los agentes antibacterianos, incluyendo ceftriaxona, y puede oscilar en gravedad de leve hasta amenazar la vida. Por lo tanto, es importante considerar el diagnóstico en pacientes quienes presentan diarrea durante o después de la administración de ceftriaxona (véase Reacciones secundarias y adversas). La interrupción de la terapia con ceftriaxona y la administración del tratamiento específico para Clostridium difficile debería ser considerado.
No se deberán administrar medicamentos que inhiban la peristalsis.
Las superinfecciones con microorganismos no susceptibles pueden presentarse como con otros agentes antibacterianos.
Insuficiencia renal y hepática grave: En la insuficiencia renal y hepática grave, se aconseja una estrecha supervisión clínica por seguridad y eficacia (véase Dosis y vía de administración).
Interferencia con pruebas serológicas: Se pueden presentar interferencias con las pruebas de Coombs, ya que ceftriaxona puede llevar a resultados de la prueba falso-positivos.
Además puede llevar a resultados falsos positivos para galactosemia (véase Reacciones secundarias y adversas).
Los métodos no enzimáticos para la determinación de glucosa en orina pueden dar resultados positivos falsos. La determinación de glucosa en la orina durante la terapia con ceftriaxona debería ser realizada enzimáticamente (véase Reacciones secundarias y adversas).
La presencia de ceftriaxona podría falsamente disminuir los valores estimados de glucosa en sangre obtenidos con algunos sistemas de monitoreo de glucosa en sangre. Favor de consultar las instrucciones de uso para cada sistema. Se deberán utilizar métodos alternativos de pruebas en caso de que sea necesario.
Espectro antibacteriano: Ceftriaxona tiene un espectro limitado de actividad antibacteriana y puede no ser adecuada para uso como un agente único para el tratamiento de algunos tipos de infecciones, a menos que el patógeno ya haya sido confirmado (véase Dosis y vía de administración). En infecciones polimicrobianas, donde se sospechan patógenos que incluyen organismos resistentes a ceftriaxona, la administración de un antibiótico adicional debería ser considerada.
Uso de lidocaína: En el caso de que una solución de lidocaína sea utilizada como solvente, las soluciones de ceftriaxona deben ser utilizadas solamente para inyección intramuscular.
La contraindicaciones para la lidocaína, advertencias y otra información relevante, como se detalla en el Resumen de Características del Producto, deben ser consideradas antes de su uso (véase Contraindicaciones). La solución de lidocaína nunca debería ser administrada intravenosamente.
Litiasis biliar: Cuando se observan opacidades en los ultrasonidos, se deberá considerar la posibilidad de precipitados de calcio ceftriaxona. Las opacidades, que se han confundido con cálculos biliares, se han detectado en los ultrasonidos de la vesícula biliar y se han observado con mayor frecuencia con dosis de ceftriaxona de 1 g por día y mayores.
Se deberá considerar precaución particularmente en la población pediátrica. Dichos precipitados desaparecen después de la descontinuación de la terapia con ceftriaxona. En raras ocasiones los precipitados de calcio ceftriaxona fueron asociados con síntomas. En casos sintomáticos, se recomienda un manejo conservador no quirúrgico y se deberá considerar la interrupción del tratamiento con ceftriaxona por parte del médico con base en la evaluación específica de riesgos/beneficios (véase Reacciones secundarias y adversas).
Estasis biliar: Casos de pancreatitis, posiblemente de etiología biliar, han sido reportados en pacientes tratados con ceftriaxona (véase Reacciones secundarias y adversas). La mayoría de los pacientes presentaron factores de riesgo para estasis biliar y lodo biliar, por ejemplo, durante una terapia principal precedente, enfermedad grave y nutrición parenteral total. Un desencadenante o cofactor de la precipitación biliar relacionada con ceftriaxona no puede ser descartado.
Litiasis renal: Casos de litiasis renal han sido reportados, que son reversibles al interrumpir ceftriaxona (véase Reacciones secundarias y adversas). En casos sintomáticos, se debería realizar la sonografía. El uso en pacientes con antecedentes de litiasis renal o con hipercalciuria debería ser considerado por el médico, con base en la valoración específica de riesgo-beneficio específica.
Efectos sobre la habilidad para conducir y usar maquinaria: Durante el tratamiento con ceftriaxona, se pueden presentar efectos no deseables (por ejemplo, mareo), los cuales pueden influir en la habilidad para conducir y usar maquinaria (véase Reacciones secundarias y adversas). Los pacientes deberían ser cuidadosos cuando conduzcan u operen maquinaria.
DOSIS Y VÍA DE ADMINISTRACIÓN:
Vía de administración: Intramuscular.
La dosis y vía de administración deberán determinarse por la gravedad y sitio de la infección, la sensibilidad del microorganismo responsable y la edad y condición del paciente. La duración normal de la terapia depende de la respuesta. Al igual que con otros antibióticos en general, la administración de ceftriaxona deberá continuarse al menos por 48 a 72 horas posteriores a que el paciente esté afebril o se obtenga evidencia de la erradicación bacteriana.
Adultos y adolescentes mayores de 12 años con un peso 50 kg: La dosis en general es de 1-2 g de ceftriaxona, administrada una vez al día (cada 24 horas). En casos de infecciones graves o causadas por microorganismos moderadamente sensibles, se puede incrementar la dosis a 4 g administrada una vez al día.
Meningitis: En adultos y adolescentes mayores de 12 años de edad y en niños con un peso ≥ 50 kg se deberá iniciar el tratamiento con 100 mg/kg/24 h una vez al día, pero sin exceder una dosis máxima de 4 g/día.
En casos de meningitis bacteriana en lactantes y niños la terapia se inicia con dosis de 50-100 mg/kg (hasta un máximo de 2 g) una vez al día. Una vez que se ha identificado al microorganismo responsable y su sensibilidad se puede reducir la dosis.
La duración del tratamiento varía dependiendo del curso de la enfermedad. Normalmente 1 a 2 semanas son suficientes.
Enfermedad de Lyme (etapas II y III): En adultos y adolescentes mayores de 12 años de edad, la dosis del tratamiento es de 50 mg/kg con un máximo de 2 g de ceftriaxona una vez al día durante 14 días.
Niños: 50-100 mg/kg de peso corporal una vez al día, hasta una dosis máxima diaria de 2 g, por 14 días.
Profilaxis perioperatoria: Para prevenir infecciones postoperatorias en cirugías contaminadas o potencialmente contaminadas, se recomienda una dosis única de 1-2 g, dependiendo del riesgo de infección, administrada de 30 a 90 minutos antes de la operación. En cirugía colorrectal, la ceftriaxona deberá administrarse con un agente antibacteriano que sea activo contra los anaerobios.
Ancianos: No se requiere ajustar la dosis de adultos considerando que las funciones renal y hepática sean adecuadas.
Neonatos y niños menores de 12 años de edad con un peso corporal de < 50 kg: Se recomiendan los siguientes esquemas de dosificación en administración diaria:
Lactantes y niños menores de 12 años de edad: La dosis diaria recomendada es de 20-50 mg/kg de peso corporal, pero se puede administrar hasta 80 mg/kg al día en infecciones graves. La dosis diaria de 80 mg/kg no debe excederse.
Las dosis mayores a 50 mg/kg de peso corporal deberán administrarse por vía intravenosa durante un periodo de 30 minutos.
En niños con un peso corporal de 50 kg o más: Se recomienda la dosis estándar del adulto.
Insuficiencia renal: En pacientes con insuficiencia renal, no se requiere modificar la dosis de ceftriaxona siempre y cuando la función hepática sea normal. Sólo en casos de insuficiencia renal grave (depuración de creatinina < 10 mL/min) la dosis diaria deberá limitarse a un máximo de 2 g.
En los pacientes en quienes coexistan la insuficiencia renal grave y la insuficiencia hepática, se deben monitorear las concentraciones plasmáticas de ceftriaxona de forma regular y se debe ajustar la dosis de forma adecuada.
Los pacientes sometidos a hemodiálisis o diálisis peritoneal no requieren de una dosis adicional de ceftriaxona después de la diálisis. Sin embargo, se deben monitorear las concentraciones plasmáticas para determinar los ajustes a la dosis necesarios, debido a que la velocidad de eliminación en esos pacientes puede reducirse.
Insuficiencia hepática: No es necesario modificar la dosis siempre y cuando la función renal sea normal. En los pacientes en quienes coexistan la insuficiencia renal grave y la insuficiencia hepática, se deben monitorear las concentraciones plasmáticas de ceftriaxona de forma regular y se debe ajustar la dosis de forma adecuada.
Método de administración de MEGION® IM: La ceftriaxona puede ser administrada por inyección intramuscular profunda. Las inyecciones intramusculares deben inyectarse en el grueso de un músculo relativamente grande y no más de 1 g en el mismo sitio.
La administración intramuscular debe considerarse cuando la vía intravenosa no es posible o es menos apropiada para el paciente.
La lidocaína es utilizada como un disolvente por lo que la solución resultante nunca debe ser administrada por vía intravenosa (véase Contraindicaciones).
Para profilaxis pre-operatoria de infecciones en el sitio de cirugía, ceftriaxona debe administrarse de 30-90 minutos antes de la cirugía.
Instrucciones para su uso y manejo: La ceftriaxona no debe ser mezclada en la misma jeringa con ningún producto medicinal diferente a una solución de clorhidrato de lidocaína al 1%.
Inyección intramuscular: 0.5 g de ceftriaxona debe ser disuelto en 2 mL, 1.0 g de ceftriaxona debe ser disuelto en 3.5 mL y ceftriaxona 2.0 g debe disolverse en 7.0 mL de solución de clorhidrato de lidocaína al 1%. La solución debe ser administrada por inyección intramuscular profunda. Dosis superiores a 1 g deben ser divididas e inyectadas en más de un sitio.
Las soluciones con lidocaína no se deben administrar intravenosamente: Cuando la ceftriaxona se reconstituya para una inyección intramuscular, el polvo cristalino blanco a naranja amarillento da como resultado una solución amarillo pálido a ámbar.
Las soluciones reconstituidas deben ser inspeccionadas visualmente. Sólo deben utilizarse soluciones transparentes libres de partículas visibles. El producto reconstituido es solamente para un uso y cualquier solución sin utilizar debe ser desechada. Use la cantidad indicada del diluyente incluido en la caja y deséchese el sobrante vaciando el contenido de la ampolleta en el inodoro.
MANIFESTACIONES Y MANEJO DE LA SOBREDOSIFICACIÓN O INGESTA ACCIDENTAL: En caso de una sobredosis pueden ocurrir náusea, vómito, diarrea. La concentración de ceftriaxona no se puede reducir por hemodiálisis o diálisis peritoneal. No hay un antídoto específico. El tratamiento es sintomático.
PRESENTACIONES:
Caja con 1 frasco ámpula con polvo con 500 mg y 1 ampolleta con 3.5 mL de diluyente lidocaína al 1%.
Caja con 1 frasco ámpula con polvo con 1 g y 1 ampolleta con 3.5 mL de diluyente lidocaína al 1%.
Todas las presentaciones con instructivo impreso.
RECOMENDACIONES SOBRE ALMACENAMIENTO: Consérvese a no más de 30°C. Consérvese la caja bien cerrada. Protéjase de la luz.
LEYENDAS DE PROTECCIÓN:
Su venta requiere receta médica. No se deje al alcance de los niños. Literatura exclusiva para médicos. No se administre si la solución no es transparente, si contiene partículas en suspensión o sedimentos. No se administre si el cierre ha sido violado. Dilúyase con lidocaína al 1% al volumen indicado. Hecha la mezcla, adminístrese de inmediato y deséchese el sobrante. El empleo de este medicamento durante el embarazo y la lactancia queda bajo responsabilidad del médico. ANTIBIÓTICO. El uso incorrecto de este producto puede causar resistencia bacteriana.
Reporte las sospechas de reacción adversa a los correos:
farmacovigilancia@cofepris.gob.mx
Distribuido por:
SANDOZ, S.A. de C.V.
La Candelaria No. 186,
Col. Atlántida, C.P. 04370,
Coyoacán, Ciudad de México, México.
Reg. Núm. 141M2002, SSA IV/347M2016, SSA (diluyente)
183300416X0023/05Abr2019/IPPA_DRA-Sandoz
®Marca Registrada