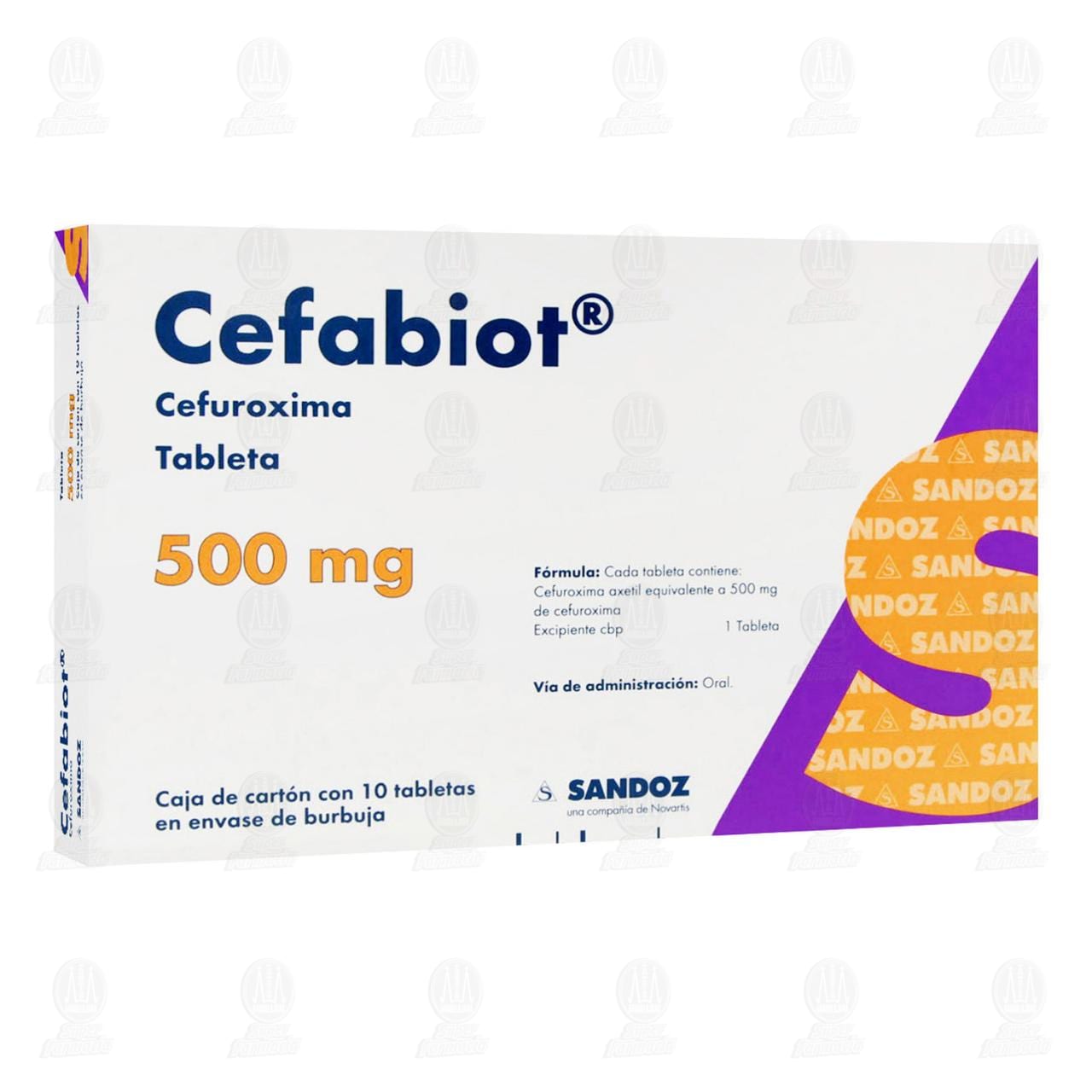
Cefabiot 500 mg, 10 Tabletas.
Agregar a favoritos
Hola! Es necesario ingresar o crear tu cuenta, para agregar productos a favoritos
Cefabiot 500 mg, 10 Tabletas.
- Precio exclusivo para venta online y pueden diferir de los precios en sucursal
- Los precios pueden variar dependiendo la zona geográfica
Controlado/antibiotico
En la venta de antibióticos se requiere receta médica que cumpla con lo requisitos legales vigentes y es necesario presentarla previamente. En medicamentos controlados es necesario receta médica junto con copia del INE correspondiente para que el pedido sea entregado.
Medicamento controlado
- En la venta de antibióticos se requiere receta médica que cumpla con lo requisitos legales vigentes y es necesario presentarla previamente. En medicamentos controlados es necesario receta médica junto con copia del INE correspondiente para que el pedido sea entregado.
- Al ser necesaria la recolección de receta este producto genera un costo adicional de $ 20.00
- La presente se considera para fines informativos sin describir características, beneficios o uso de los medicamentos. Esta información únicamente será destinada para exponer el precio de estos productos. Cualquier duda relacionada con sus características, propiedades y empleo deberá ser consultada con su médico
Para conocer la disponibilidad del producto ingresa tu código postal
FORMA FARMACÉUTICA Y FORMULACIÓN:
Cada TABLETA contiene:
Acetoxietil de Cefuroxima equivalente a 500 mg
de cefuroxima
Excipiente cbp 1 tableta
INDICACIONES TERAPÉUTICAS: CEFABIOT® está indicado para el tratamiento de infecciones de leves a moderadas causadas por gérmenes sensibles, como:
Infecciones del tracto respiratorio superior: Otitis media aguda, sinusitis, amigdalitis y faringitis.
Infecciones del tracto respiratorio inferior: Bronquitis aguda y exacerbaciones de bronquitis crónica, neumonía.
Infecciones del tracto genitourinario: Pielonefritis, cistitis y uretritis. Uretritis y cervicitis gonocócica no complicadas.
Infecciones de la piel y tejidos blandos: Forunculosis, piodermia e impétigo.
Enfermedad de Lyme en etapa temprana (estadio I): Tratamiento de adultos y niños mayores de 12 años en la etapa temprana de la enfermedad de Lyme y prevención del progreso a etapas tardías y complicaciones de la misma.
Se recomienda considerar las guías oficiales del uso apropiado de los agentes antibacterianos.
CONTRAINDICACIONES: Hipersensibilidad a cefuroxima o a cualquier otro de los excipientes enlistados en la fórmula.
Pacientes con hipersensibilidad a los antibióticos del grupo de cefalosporinas.
Historia de hipersensibilidad severa (p.e. reacción anafiláctica) a cualquier otro de los agentes antibacterianos del tipo beta-lactámicos (penicilinas, monobactamos y carbapenems).
RESTRICCIONES DE USO DURANTE EL EMBARAZO Y LA LACTANCIA:
Uso durante el embarazo: Hay datos limitados con el uso de CEFABIOT® en mujeres embarazadas. Estudios en animales no han mostrado efectos nocivos durante el embarazo, desarrollo embrionario o fetal, parto o desarrollo postnatal. CEFABIOT® debe ser prescrito en mujeres embarazadas solamente si el beneficio es superior al riesgo.
Uso durante la lactancia: Cefuroxima se excreta por la leche materna en pequeñas cantidades. No se espera el desarrollo de eventos adversos a dosis terapéuticas, sin embargo, el riesgo de diarrea e infección micótica en membranas de mucosas no debe excluirse. La lactancia debe suspenderse debido a estos efectos. La posibilidad de sensibilización debe ser tomada en cuenta. CEFABIOT® debe ser utilizado solamente durante la lactancia después de evaluar el riesgo/beneficio por el médico a cargo.
REACCIONES SECUNDARIAS Y ADVERSAS: Los eventos adversos más comunes son sobrecrecimiento de cándida, eosinofilia, cefalea, mareos, alteraciones gastrointestinales e incremento transitorio de enzimas hepáticas.
Las frecuencias asignadas para los eventos adversos descritos a continuación son estimadas ya que la mayoría de los datos que pueden ser útiles (p.e. de los estudios controlados con placebo) para calcular su incidencia no están disponibles. Además, la incidencia de eventos adversos asociados con CEFABIOT® pueden variar de acuerdo a la indicación.
Se utilizaron datos de estudios clínicos para determinar la frecuencia de eventos adversos muy comunes o raros. Las frecuencias asignadas al resto de los efectos indeseables (es decir, aquellos que ocurren < 1/10,000) fueron principalmente determinadas utilizando datos post comercialización y refiriéndose a la tasa de reportes más que a la frecuencia real. No hay datos disponibles de estudios clínicos controlados con placebo.
Cuando las incidencias se obtuvieron a partir de datos de estudios clínicos, éstas se calcularon con base en los datos relacionados con el medicamento (de acuerdo con la evaluación del investigador). Dentro de cada grupo de frecuencia, los efectos indeseables se presentan en orden decreciente en severidad.
La siguiente convención ha sido utilizada para la clasificación de frecuencia: muy común ≥ 1/10; común ≥ 1/100 a < 1/10; poco común ≥ 1/1,000 a < 1/100; raros ≥ 1/10,000 a < 1/1,000; muy raros < 1/10,000 y desconocidos (no pueden estimarse de los datos disponibles).
Infecciones e infestaciones:
Común: sobrecrecimiento de Candida.
Desconocido: sobrecrecimiento de Clostridium difficile.
Alteraciones en sangre y sistema linfático:
Común: eosinofilia.
Poco común: prueba de Coomb´s positiva, trombocitopenia, leucopenia (algunas veces profunda).
Desconocido: anemia hemolítica.
Alteraciones del sistema inmune:
Desconocido: fiebre, enfermedad del suero, anafilaxia, reacción de Jarisch-Herxheimer.
Alteraciones del sistema nervioso:
Común: cefalea, mareos.
Alteraciones gastrointestinales:
Común: diarrea, náusea, dolor abdominal.
Poco común: vómito.
Desconocido: colitis pseudomembranosa.
Alteraciones hepatobiliares:
Común: incremento transitorio en los niveles de enzimas hepáticas.
Desconocido: ictericia (predominantemente colestásica), hepatitis.
Alteraciones de piel y tejidos blandos:
Poco común: rash.
Desconocido: urticaria, prurito, eritema multiforme, síndrome de Stevens-Johnson, necrólisis tóxica epidermal (necrólisis exantemática) (ver Alteraciones del sistema inmune), edema angioneurótico.
Descripción de reacciones adversas selectas: Todas las cefalosporinas, tienden a absorberse en la superficie de la membrana de las células rojas y reaccionar con los anticuerpos dirigidos contra el fármaco para producir una prueba de Coombs positiva (lo que puede interferir con las pruebas cruzadas de sangre) y, muy raramente, anemia hemolítica.
Se han observado elevaciones séricas transitorias de enzimas hepáticas, las cuales son usualmente reversibles.
Población pediátrica: El perfil de seguridad de axetil cefuroxima en niños es consistente con el perfil de los adultos.
PRECAUCIONES EN RELACIÓN CON EFECTOS DE CARCINOGÉNESIS, MUTAGÉNESIS, TERATOGÉNESIS Y SOBRE LA FERTILIDAD: No se han reportado efectos sobre la carcinogénesis, mutagénesis y teratogénesis. Los datos preclínicos no fueron relevantes para el uso de CEFABIOT®.
Fertilidad: No hay datos sobre los efectos del CEFABIOT® en fertilidad en humanos. Se realizaron estudios sobre reproducción en animales sin mostrar efectos sobre la fertilidad.
INTERACCIONES MEDICAMENTOSAS Y DE OTRO GÉNERO: Los fármacos que reducen la acidez gástrica pueden disminuir la biodisponibilidad de CEFABIOT®, lo cual es comparable con la administración en ayuno, tendiendo a cancelar el efecto de la mayor absorción después de los alimentos.
CEFABIOT® podría afectar la flora intestinal, induciendo una disminución en la reabsorción de estrógenos y disminución de la eficacia de los anticonceptivos orales combinados.
La cefuroxima es excretada por filtración glomerular y secreción tubular. No se recomienda el uso concomitante de probenecid. La administración concurrente de probenecid incrementa significativamente el pico de concentración sérica, el área bajo la curva de concentración vs. tiempo y la vida media en la eliminación de cefuroxima.
El uso concomitante con anticoagulantes orales puede ocasionar un incremento en INR (lnternational Normalized Ratio), de la coagulación sanguínea.
PRECAUCIONES GENERALES:
Reacciones de hipersensibilidad: Se deben indicar cuidados especiales en pacientes que hayan experimentado una reacción alérgica a penicilinas u otros antibióticos beta lactámicos porque pueden presentan el riesgo de reacciones de sensibilidad cruzada. Así como en todos los agentes antibacterianos beta lactámicos, se han reportado reacciones de hipersensibilidad serias y en ocasiones fatales. En caso de reacciones de hipersensibilidad severa, el tratamiento con CEFABIOT® debe ser suspendido inmediatamente e iniciar medidas de urgencia adecuadas.
Antes del inicio de tratamiento, se debe establecer mediante una historia clínica, si el paciente tiene antecedentes de reacciones de hipersensibilidad severa a cefuroxima, a otras cefalosporinas o cualquier otro tipo de agentes beta lactámicos. La cefuroxima debe ser usada con precaución si se administra a pacientes con antecedentes de hipersensibilidad no severa a otros agentes beta lactámicos.
Reacción Jarisch-Herxheimer: La reacción Jarisch-Herxheimer se ha observado después del tratamiento con CEFABIOT® para la enfermedad de Lyme. Esta reacción es el resultado directo de la actividad bactericida del CEFABIOT® sobre la bacteria causante de la enfermedad de Lyme, la espiroqueta Borrelia burgdorferi. Los pacientes deben ser informados que esto es común y generalmente una consecuencia autolimitada de la antibioticoterapia de la enfermedad de Lyme.
Sobrecrecimiento de microorganismos no susceptibles: Así como con otros antibióticos, el uso de CEFABIOT® puede inducir el sobrecrecimiento de cándida. El uso prolongado también podría inducir el sobrecrecimiento de otros microorganismos no susceptibles (p.e. enterococos y Clostridium difficile), lo cual requiere la interrupción del tratamiento.
Se ha reportado colitis pseudomembranosa asociada al uso de casi todos los agentes antibacterianos, incluyendo CEFABIOT® y con un rango de severidad que varía de leve hasta peligro para la vida. Este diagnóstico debe ser considerado en pacientes con diarrea, durante o posterior a la administración de CEFABIOT®. La suspensión del tratamiento con CEFABIOT® y la administración de tratamiento específico para Clostridium difficile se debe considerar. No se deben administrar medicamentos que inhiban el peristaltismo.
Se debe tener precaución en pacientes fenilcetonúricos por el contenido de aspartamo en el recubrimiento de la tableta (0.3 mg y 0.4 mg de aspartamo para la tableta de 250 mg y 500 mg respectivamente).
DOSIS Y VÍA DE ADMINISTRACIÓN: Oral.
Las tabletas de CEFABIOT® están recubiertas para mejorar su sabor, no deben masticarse.
La duración normal del tratamiento es de 7 días, pero puede variar de 5 a 10 días de acuerdo con la severidad del proceso infeccioso.
Faringoamigdalitis por Streptococcus pyogenes: La duración de la terapia debe ser de al menos 10 días.
Enfermedad de Lyme: La duración del tratamiento es de 20 días. Para una absorción óptima, CEFABIOT® debe ser ingerido poco después de los alimentos. La dosis depende de la severidad de la infección.
Tabla de dosificación:
|
Adultos y niños mayores de 12 años |
Dosis |
|
Infecciones del tracto respiratorio superior |
250-500 mg dos veces al día. |
|
Infecciones del tracto respiratorio inferior |
500 mg dos veces al día. |
|
Infecciones del tracto genitourinario sin complicaciones |
125-250 mg dos veces al día. |
|
Infecciones de la piel y tejido subcutáneo |
250-500 mg dos veces al día. |
|
Enfermedad de Lyme (etapa temprana) |
500 mg dos veces al día por 20 días. |
Tabla de dosificación:
|
Niños de 5 a 12 años de edad |
Dosis |
|
Las indicaciones arriba mencionadas, si es relevante para este grupo de edad |
125-250 mg dos veces al día. |
|
Otitis media aguda |
250 mg dos veces al día. |
Niños menores de 5 años: Las tabletas de CEFABIOT® no son apropiadas para niños menores de 5 años.
Dosificación en insuficiencia renal, en pacientes con diálisis y ancianos: No se requieren precauciones especiales en pacientes con insuficiencia renal, o en pacientes ancianos si la dosis diaria no excede de 1 g. En pacientes con insuficiencia renal y depuración de creatinina menor a 20 mL/min la dosificación de CEFABIOT® debe hacerse con precaución. Los pacientes que están bajo hemodiálisis requieren una dosis suplementaria de CEFABIOT® al final de cada tratamiento de diálisis.
MANIFESTACIONES Y MANEJO DE LA SOBREDOSIFICACIÓN O INGESTA ACCIDENTAL: La sobredosis puede dejar secuelas neurológicas incluyendo encefalopatía, convulsiones y coma. Los síntomas de sobredosis pueden ocurrir si la dosis no se reduce en forma apropiada en pacientes con daño renal.
Los niveles séricos de cefuroxima pueden reducirse mediante hemodiálisis y diálisis peritoneal.
PRESENTACIONES:
Caja de cartón con 10 o 14 tabletas en envase de burbuja e instructivo impreso.
RECOMENDACIONES SOBRE ALMACENAMIENTO:
Consérvese o manténgase a no más de 30°C.
Consérvese la caja bien cerrada.
LEYENDAS DE PROTECCIÓN:
Literatura exclusiva para médicos. ANTIBIÓTICO. El uso incorrecto de este producto, puede causar resistencia bacteriana. Su venta requiere receta médica. No se deje al alcance de los niños. El empleo de este medicamento durante el embarazo y la lactancia queda bajo la responsabilidad del médico. Atención fenilcetonúricos, este producto contiene fenilalanina. Contiene aspartamo.
Reporte las sospechas de reacción adversa al correo de:
farmacovigilancia@cofepris.gob.mx
SANDOZ, S.A. de C.V.
La Candelaria No. 186,
Col. Atlántida, C.P. 04370,
Deleg. Coyoacán,
Ciudad de México, México.
Reg. Núm. 075M2005, SSA IV
183300416T0159/23Abr2018/IPPA_DRA-Sandoz
®Marca Registrada