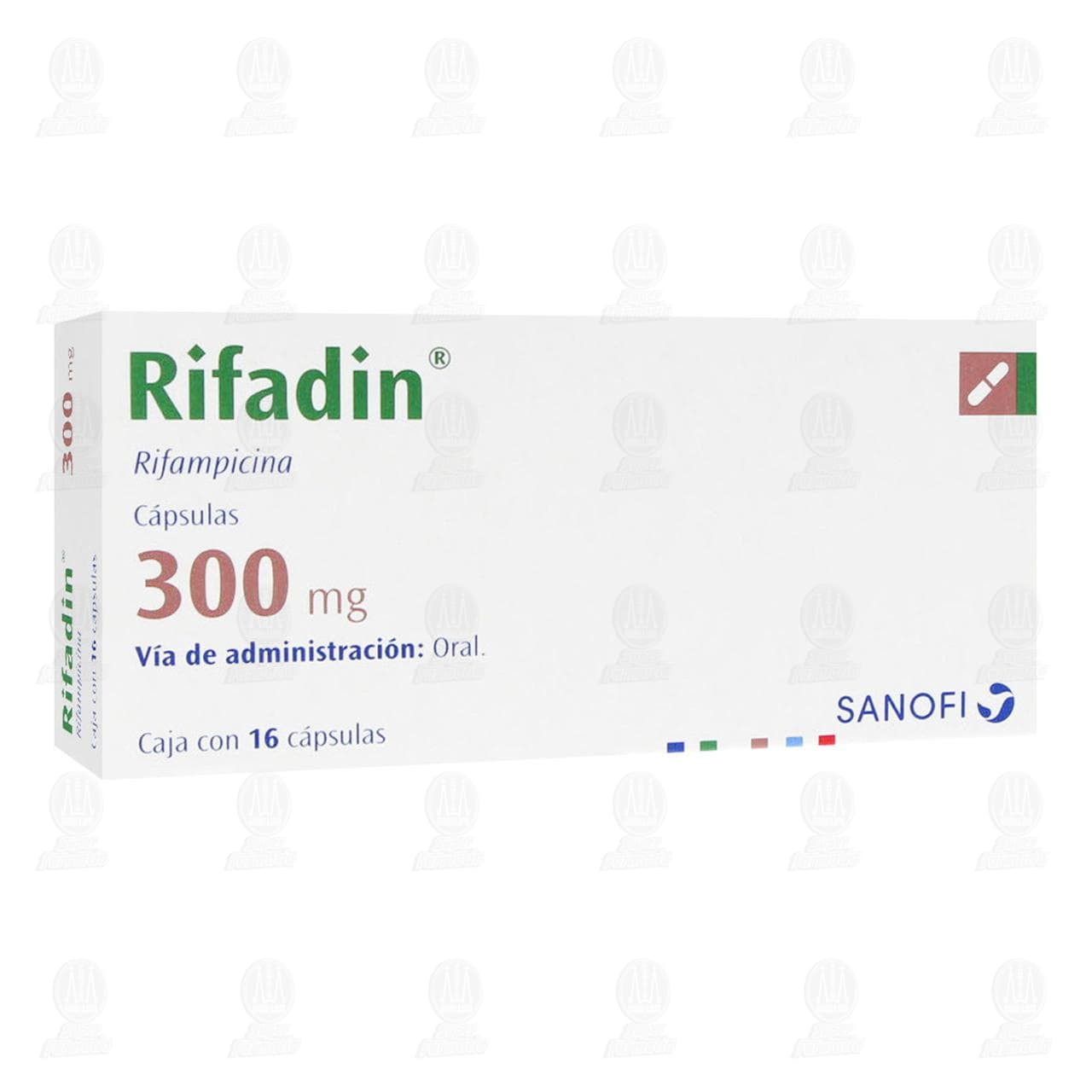
Rifadin 300 mg, 16 Cápsulas.
Agregar a favoritos
Hola! Es necesario ingresar o crear tu cuenta, para agregar productos a favoritos
Rifadin 300 mg, 16 Cápsulas.
- Precio exclusivo para venta online y pueden diferir de los precios en sucursal
- Los precios pueden variar dependiendo la zona geográfica
Controlado/antibiotico
En la venta de antibióticos se requiere receta médica que cumpla con lo requisitos legales vigentes y es necesario presentarla previamente. En medicamentos controlados es necesario receta médica junto con copia del INE correspondiente para que el pedido sea entregado.
Medicamento controlado
- En la venta de antibióticos se requiere receta médica que cumpla con lo requisitos legales vigentes y es necesario presentarla previamente. En medicamentos controlados es necesario receta médica junto con copia del INE correspondiente para que el pedido sea entregado.
- Al ser necesaria la recolección de receta este producto genera un costo adicional de $ 20.00
- La presente se considera para fines informativos sin describir características, beneficios o uso de los medicamentos. Esta información únicamente será destinada para exponer el precio de estos productos. Cualquier duda relacionada con sus características, propiedades y empleo deberá ser consultada con su médico
Para conocer la disponibilidad del producto ingresa tu código postal
FORMA FARMACÉUTICA Y FORMULACIÓN:
Cada CÁPSULA contiene:
|
Rifampicina |
300 mg |
|
Excipiente cbp 1 cápsula. |
|
INDICACIONES TERAPÉUTICAS:
Tuberculosis: RIFADIN® está indicado en el tratamiento de todas las formas de tuberculosis, incluyendo casos recientes, avanzados, crónicos y casos resistentes a tratamiento. RIFADIN® siempre debe asociarse a por lo menos otro fármaco antituberculoso.
Lepra: RIFADIN® está indicado en el tratamiento de la lepra multibacilar y paucibacilar para provocar la conversión del estado infeccioso a un estado no infeccioso. RIFADIN® debe asociarse a por lo menos otro fármaco antileproso.
Infecciones estafilocócicas graves y meticilino-resistentes: RIFADIN® puede emplearse en infecciones estafilocócicas graves y en meticilino-resistentes, siempre asociada a otro antibiótico apropiado.
Brucelosis: RIFADIN® puede ser utilizado en el tratamiento de la brucelosis. En tales circunstancias debe asociarse a doxiciclina.
Portadores asintomáticos de N. meningitidis: RIFADIN® está indicado en el tratamiento de portadores asintomáticos de N. meningitidis para eliminar los meningococos de la nasofaringe. (RIFADIN® no está indicado en el tratamiento de la infección meningocócica debido a la posibilidad de un rápido desarrollo de gérmenes resistentes).
Portadores asintomáticos de H. influenzae: RIFADIN® está indicado tanto en los portadores asintomáticos de H. influenzae, como en la quimioprofilaxis de niños menores de 4 años que hayan estado expuestos al contagio con este germen.
Otras infecciones: Infecciones causadas por gérmenes sensibles a RIFADIN® tales como: estafilococos, estreptococos, N. gonorrhoeae, Proteus sp., H. influenzae, E. coli, Legionella sp.
Para prevenir la aparición de microorganismos resistentes, RIFADIN® deberá ser administrado siempre con otro agente antibacteriano hacia el cual el microorganismo sea sensible.
FARMACOCINÉTICA Y FARMACODINAMIA: RIFADIN® inhibe la actividad de la RNA polimerasa dependiente de DNA en células sensibles. Específicamente interactúa con la RNA polimerasa bacteriana, y no inhibe a la enzima de mamíferos.
RIFADIN® es particularmente activo contra microorganismos extracelulares de crecimiento rápido, pero también tiene actividad bactericida intracelularmente y contra M. tuberculosis de crecimiento lento e intermitentemente.
También es activo in vitro contra el Complejo Mycobacterium avium, M. kansasii y M. leprae.
RIFADIN® es activo in vitro contra una variedad de microorganismos grampositivos y gramnegativos. Los microorganismos sensibles incluyen: Neisseria meningitidis, Neisseria gonorrhoeae, Staphylococcus aureus, Proteus spp., Staphylococcus epidermidis, H. influenzae, E. coli, Pseudomonas aeruginosa, Legionella pneumophila, Brucella sp. y Streptococcus pyogenes. Tanto las cepas productoras como las no productoras de penicilinasa y los estafilococos resistentes a betalactámicos son sensibles a RIFADIN®.
La resistencia cruzada a rifampicina sólo ha sido mostrada con otras rifamicinas.
Se ha reportado que RIFADIN® posee potencial inmunosupresor en conejos, ratones, ratas, hámsters, linfocitos humanos in vitro y en humanos.
Farmacocinética: La absorción de RIFADIN® oral se reduce cuando se ingiere con alimentos.
RIFADIN® es fácilmente absorbido desde el tracto gastrointestinal. Las concentraciones sanguíneas pico en adultos normales y niños varían ampliamente de un individuo a otro. Las concentraciones séricas pico del orden de 10 µg/mL se presentan alrededor de 2 a 4 horas después de la administración de una dosis de 10 mg/Kg de peso corporal, con el estómago vacío.
La farmacocinética oral en niños es similar a la de adultos.
En sujetos normales, la vida media biológica de RIFADIN® en suero es en promedio de alrededor de 3 horas después de una dosis de 600 mg, y se incrementa a 5.1 horas después de una dosis de 900 mg. Con la administración repetida, la vida media disminuye y alcanza valores promedio en aproximadamente 2 a 3 horas.
A dosis de hasta 600 mg/día la vida media no difiere en pacientes con insuficiencia renal y, consecuentemente, no se requiere ajuste de dosis.
Después de la absorción, RIFADIN® se elimina rápidamente por la bilis y se genera una circulación enterohepática. Durante este proceso, RIFADIN® sufre desacetilación progresiva de manera que casi todo el fármaco se metaboliza a esta forma en la bilis, en aproximadamente 6 horas.
Este metabolito mantiene actividad antibacteriana.
La reabsorción intestinal se reduce por la desacetilación y así se facilita la eliminación. Hasta el 30% de una dosis se excreta en la orina, con alrededor de la mitad de esta fracción como medicamento inalterado.
RIFADIN® es ampliamente distribuido en el cuerpo. Está presente en concentraciones efectivas en varios órganos y líquidos corporales, incluyendo el líquido cefalorraquídeo.
Alrededor de 80% de RIFADIN® se une a proteínas, y la mayor parte de la fracción no unida no está ionizada y, por lo tanto, se difunde libremente en los tejidos.
CONTRAINDICACIONES: RIFADIN® está contraindicado en pacientes con historia de hipersensibilidad a alguna de las rifampicinas.
El uso de RIFADIN® está contraindicado cuando se administra concomitantemente con la combinación de saquinavir/ritonavir. (Ver sección de Interacciones medicamentosas y de otro género).
RESTRICCIONES DE USO DURANTE EL EMBARAZO Y LA LACTANCIA: En la mujer embarazada no se han realizado estudios controlados con RIFADIN®.
RIFADIN® ha demostrado ser teratogénico en roedores cuando se administra en grandes dosis.
Se ha reportado que RIFADIN® atraviesa la barrera placentaria y aparece en la sangre del cordón umbilical. Aún no se conoce el efecto de la rifampicina, ya sea sola o en combinación con otro medicamento antituberculoso, sobre el feto humano. Cuando se administra durante las últimas semanas del embarazo, RIFADIN® puede causar hemorragias postnatales tanto en el recién nacido como en la madre, por lo que se recomienda el tratamiento con vitamina K. En consecuencia, RIFADIN® debe administrarse durante el embarazo o en mujeres con potencial de embarazarse sólo si los beneficios potenciales para la paciente superan los posibles riesgos para el feto.
RIFADIN® se excreta en la leche materna. Por lo tanto, RIFADIN® debe administrarse durante la lactancia sólo si los beneficios potenciales para la paciente superan los posibles riesgos para el lactante.
REACCIONES SECUNDARIAS Y ADVERSAS:
Infecciones e Infestaciones: Se ha reportado colitis pseudomembranosa con el tratamiento con RIFADIN®.
Alteraciones del sistema linfático y sanguíneo: Puede presentarse trombocitopenia, con o sin púrpura, generalmente asociada a un tratamiento intermitente, la cual es reversible si el fármaco se suspende inmediatamente. Se han reportado casos de hemorragia cerebral y muerte cuando la administración de RIFADIN® se continuó o reinició después de la aparición de púrpura. Excepcionalmente se ha reportado coagulación intravascular diseminada. En un pequeño porcentaje de pacientes tratados con RIFADIN® se ha presentado eosinofilia y leucopenia. Muy raramente se ha reportado agranulocitosis.
Alteraciones endocrinas: Se han presentado raros casos de insuficiencia adrenal en pacientes con función adrenal comprometida.
Alteraciones psiquiátricas: Excepcionalmente se ha reportado psicosis.
Alteraciones gastrointestinales: Reacciones gastrointestinales como anorexia, náusea, vómito, malestar abdominal y diarrea.
Alteraciones hepáticas: RIFADIN® puede causar hepatitis, por lo que deben monitorearse las pruebas de función hepática.(Ver sección de Precauciones generales).
Alteraciones dermatológicas: Pueden ocurrir reacciones cutáneas leves y autolimitadas que no parecen ser de hipersensibilidad. Típicamente incluyen rubor y prurito con o sin eritema. Son menos frecuentes la urticaria y reacciones cutáneas de hipersensibilidad más graves. Fueron reportados casos excepcionales de reacción penfigoide, eritema multiforme, incluyendo síndrome de Stevens-Johnson, necrólisis epidérmica tóxica y vasculitis.
Alteraciones musculoesqueléticas y del tejido conectivo: En un pequeño porcentaje de pacientes tratados con RIFADIN® se han reportado debilidad muscular y miopatía.
Alteraciones del sistema reproductivo y mama: Ocasionalmente se ha reportado trastornos del ciclo menstrual en mujeres que reciben terapia antituberculosa prolongada con regímenes que incluyen RIFADIN®.
Las reacciones adversas que se presentan habitualmente con tratamiento intermitente, y que muy probablemente son de origen inmunológico incluyen: síndrome pseudogripal, caracterizado por episodios de fiebre, escalofríos, cefalea, mareos y dolor óseo; falta de aire y sibilancias; caída de la presión sanguínea y choque; anafilaxia; anemia hemolítica aguda; insuficiencia renal aguda, debida generalmente a necrosis tubular aguda o a nefritis intersticial aguda.
PRECAUCIONES EN RELACIÓN CON EFECTOS DE CARCINOGÉNESIS, MUTAGÉNESIS, TERATOGÉNESIS Y SOBRE LA FERTILIDAD:
Carcinogenicidad: No se dispone de datos en humanos sobre potencial de carcinogenicidad a largo plazo. Se han reportado algunos casos de crecimiento acelerado de carcinoma de pulmón en el hombre; sin embargo, no se ha establecido una relación causal con el medicamento. En ratones hembra de una cepa conocida por ser susceptible al desarrollo espontáneo de hepatomas, se observó aumento en la incidencia de los mismos cuando se administró RIFADIN® en dosis 2 a 10 veces el promedio de la dosis humana diaria durante 60 semanas, y un periodo de observación de 46 semanas. Bajo las mismas condiciones experimentales, no se ha encontrado evidencia de carcinogenicidad en ratones macho de la misma cepa, en ratones de diferentes cepas, o en ratas. Se ha reportado que RIFADIN® tiene potencial inmunosupresor en conejos, ratones, ratas, cobayos, linfocitos humanos in vitro y humanos.
RIFADIN® ha mostrado actividad antitumoral in vitro.
Mutagenicidad: No se cuenta con datos en humanos sobre potencial de mutagenicidad a largo plazo. No hay evidencia de mutagenicidad en bacterias, Drosophila melanogaster o ratones. Se ha observado aumento en la ruptura de cromátidas cuando cultivos de células sanguíneas fueron tratados con RIFADIN®. También se ha observado in vitro aumento en la frecuencia de aberraciones cromosómicas en linfocitos de pacientes tratados con RIFADIN® en combinación con isoniazida y pirazinamida, y con RIFADIN® en combinación con isoniazida, pirazinamida y estreptomicina.
Teratogenicidad: A dosis elevadas, la rifampicina presenta acción teratogénica en roedores.
Fertilidad: No se cuenta con datos en humanos sobre potencial de deterioro de la fertilidad a largo plazo.
INTERACCIONES MEDICAMENTOSAS Y DE OTRO GÉNERO:
Interacción con la enzima del citocromo P-450: Tomando en cuenta que RIFADIN® tiene propiedades inductoras de ciertas enzimas del citocromo P-450, la coadministración de RIFADIN® con otros medicamentos que son metabolizados por estas enzimas del citocromo P-450 pueden acelerar el metabolismo y reducir la actividad de estos medicamentos. Por consiguiente, debe tenerse precaución cuando se prescriba RIFADIN® con los medicamentos que se metabolizan por el citocromo P-450. Para mantener niveles terapéuticos adecuados en sangre, la dosificación del medicamento metabolizado por estas enzimas puede requerir de un ajuste de dosis, tanto al inicio como al término del tratamiento concomitante con RIFADIN®.
Ejemplo de medicamentos metabolizados por enzimas del citocromo P-450 son: Anticonvulsivantes (por ej. fenitoína), antiarrítmicos (por ej. disopiramida, mexiletina, quinidina, propafenona, tocainida), antiestrógenos (por ejem. tamoxifén, toremifén), antipsicóticos (por ej. haloperidol), anticoagulantes orales (por ej. warfarina), antifúngicos (por ej. fluconazol, itraconazol, ketoconazol), medicamentos antirretrovirales (por ej. zidovudina, saquinavir, indinavir, efavirenz), barbitúricos, beta-bloqueadores, benzodiazepinas (por ej. diazepam), medicamentos relacionados con benzodiazepinas (por ej. zopiclona, zolpidem), calcioantagonistas (por ej. diltiazem, nifedipino, verapamil), cloranfenicol, claritromicina, corticosteroides, glucósidos cardiacos, clofibrato, anticonceptivos hormonales sistémicos, dapsona, doxiciclina, estrógenos, fluoroquinolonas, gestrinona, hipoglucemiantes orales (sulfonilureas), agentes inmunosupresores (por ej. ciclosporina, tracolimus), irinotecan, levotiroxina, losartán, analgésicos narcóticos, metadona, prazicuantel, progestinas, quinina, riluzol, receptor antagonista 5-HT3 selectivo (por ej. ondansetrón) estatinas metabolizadas por CYP 3A4, telitromicina, teofilina, tiazolidinedionas (por ej. rosiglitazona), antidepresivos tricíclicos (por ej. amitriptilina, nortriptilina).
Las pacientes que usen anticonceptivos hormonales sistémicos deben ser advertidas de que cambien a un método anticonceptivo no hormonal durante el tratamiento con rifampicina.
Otras interacciones: Cuando RIFADIN® se administra concomitantemente con la combinación de saquinavir/ritonavir se incrementa el potencial de hepatotoxicidad. Por ello, el uso concomitante de RIFADIN® con saquinavir/ritonavir está contraindicado (ver Contraindicaciones).
Cuando RIFADIN® se administra en forma concomitante con atovacuona, se observan concentraciones disminuidas de atovacuona y aumentadas de rifampicina.
El uso concomitante de ketoconazol y RIFADIN® resulta en concentraciones séricas menores de ambos medicamentos.
El uso concomitante de RIFADIN® y enalapril resulta en concentraciones menores de enalaprilato, el metabolito activo del enalapril. Si la condición clínica del paciente así lo indica, deben efectuarse ajustes a la dosis.
La administración concomitante de antiácidos puede reducir la absorción de RIFADIN®. Las dosis diarias de RIFADIN® deben ser administradas por lo menos una hora antes de la ingestión de antiácidos.
Cuando RIFADIN® se administra junto con halotano o isoniazida, el potencial de hepatotoxicidad se incrementa, por lo que el uso concomitante de RIFADIN® y halotano debe ser evitado.
Pacientes en tratamiento con RIFADIN® e isoniazida deben ser monitoreados cuidadosamente por el riesgo de hepatotoxicidad.
ALTERACIONES EN LOS RESULTADOS DE PRUEBAS DE LABORATORIO: Los niveles terapéuticos de RIFADIN® inhiben los métodos microbiológicos estándar para folato y vitamina B12 en suero, por lo que deben considerarse métodos alternos.
También se ha observado elevación transitoria de bilirrubina sérica (ver Precauciones generales). RIFADIN® puede deteriorar la excreción biliar de los medios de contraste usados para la visualización de la vesícula biliar, debido a la competencia por la excreción biliar. Por lo tanto, estas pruebas deben realizarse antes de la dosis matutina de RIFADIN®.
Cuando se usa el método KIMS (Kinetic Interaction of Microparticles in Solution) (por ej. el ensayo de opiáceos Abuscreen OnLine; Sistema de Diagnóstico Roche), se han reportado pruebas para opiáceos con reactividad cruzada y falsos-positivos de orina en pacientes que recibieron RIFADIN®. Pruebas de confirmación, como la cromatografía de gases/espectrometría de masas, pueden distinguir a la rifampicina de los opiáceos.
PRECAUCIONES GENERALES:
Advertencias:
Hígado: Pacientes con insuficiencia hepática deben recibir RIFADIN® sólo en caso de necesidad, y aún así debe ser utilizado con precaución y bajo estricta vigilancia médica, controlando la función hepática. En estos casos debe prestarse especial atención a la función hepática mediante la evaluación de la alanina aminotransferasa (ALT) sérica y la aspartato aminotransferasa (AST) sérica, antes de iniciar el tratamiento y durante el curso del mismo cada 2 a 4 semanas. Si se detectan signos de daño hepatocelular, RIFADIN® debe suspenderse inmediatamente.
En algunos casos puede ocurrir hiperbilirrubinemia en los primeros días de tratamiento, resultante de la competencia entre RIFADIN® y la bilirrubina por la vía de eliminación hepática. Un hallazgo aislado de elevación moderada de bilirrubina y/o transaminasas no constituye por sí mismo una indicación para interrumpir el tratamiento con RIFADIN®. Esta decisión debe tomarse después de repetir las pruebas de laboratorio, y evaluar la tendencia de los niveles enzimáticos, teniendo en cuenta la condición clínica del paciente.
Reacciones inmunológicas/Anafilaxia: Debido a que pueden presentarse reacciones inmunológicas incluyendo anafilaxia cuando el tratamiento se administra en forma intermitente (menos de 2-3 veces por semana), los pacientes deben monitorearse estrechamente. Los pacientes deben ser advertidos de las reacciones que pueden ocurrir si interrumpen el tratamiento.
Precauciones: En adultos que fueron tratados con RIFADIN® por tuberculosis, deben realizarse exámenes basales de enzimas hepáticas, bilirrubina, creatinina sérica, biometría hemática completa y cuenta plaquetaria (o estimada). Los exámenes basales no son necesarios en niños, a no ser que haya indicios clínicos o se conozca algún tipo de complicación.
Los pacientes deben ser observados por lo menos mensualmente durante la terapia e interrogados específicamente sobre síntomas asociados a reacciones adversas. Todos los pacientes con anomalías deben ser monitoreados, incluyendo pruebas de laboratorio, en caso necesario.
RIFADIN® tiene propiedades inductoras enzimáticas que pueden aumentar el metabolismo de sustratos endógenos, incluyendo hormonas (adrenal, tiroidea) y vitamina D. Reportes aislados han asociado una exacerbación de la porfiria con la administración de RIFADIN®, como resultado de la inducción de la enzima ácido delta-aminolevulínico-sintetasa.
RIFADIN® puede producir una coloración rojiza de la orina, sudor, esputo y lágrimas, por lo que debe advertirse al paciente sobre esta posibilidad. Los lentes de contacto blandos pueden teñirse de manera permanente.
DOSIS Y VÍA DE ADMINISTRACIÓN: RIFADIN® debe administrarse en ayunas, por lo menos 30 minutos antes o 2 horas después de comer.
Adultos:
Tuberculosis: Para el tratamiento de la tuberculosis, RIFADIN® siempre debe ser administrada a razón de 10 mg/kg diarios, sin exceder 600 mg/día, junto con por lo menos un medicamento antituberculoso.
Quimioterapia de corto plazo:
Fase inicial (2 meses): Administrar RIFADIN®, isoniazida, pirazinamida y estreptomicina o etambutol diariamente o dos a tres veces por semana, bajo terapia de observación directa. En poblaciones con baja probabilidad conocida de resistencia a la isoniazida, puede ser aceptable un régimen inicial con menos de cuatro medicamentos. Deberá consultarse a un médico experto en tuberculosis en caso de que el paciente permanezca sintomático o con esputo o cultivo positivo después de este periodo.
Fase de continuación (4 meses ó más): Para microorganismos sensibles, administrar RIFADIN® e isoniazida diariamente ó 2 a 3 veces por semana bajo observación directa para organismos susceptibles. Deberá consultarse a un médico experto en tuberculosis para el tratamiento de microorganismos resistentes a los medicamentos administrados.
En general, la terapia contra tuberculosis debe tener una duración de 6 meses hasta que por lo menos hayan transcurrido 3 meses de conversión a cultivo negativo.
Terapia a largo plazo: Pacientes con microorganismos resistentes a los medicamentos o con tuberculosis extrapulmonar pueden necesitar tratamientos más largos con otros esquemas terapéuticos.
Tuberculosis con infección por VIH: El tratamiento debe tener una duración total de 9 meses, o por lo menos 6 meses después de la conversión del cultivo.
Lepra: La dosis recomendada es 600 mg diarios o mensuales. RIFADIN® siempre debe asociarse a por lo menos otro medicamento antileproso.
Infecciones estafilocócicas meticilino-resistentes: La dosis diaria recomendada es 600-1,200 mg/día, administrados en 2 a 4 dosis divididas. RIFADIN® debe asociarse siempre a por lo menos otro antibiótico.
Infecciones estafilocócicas severas: La dosis diaria recomendada es de 600-1,200 mg/día, administrados en dosis divididas cada 12 horas, con por lo menos otro antibiótico adecuado.
Brucelosis: La dosis recomendada es 900 mg/día administrados diariamente al mediodía. RIFADIN® siempre debe asociarse con doxiciclina (200 mg/día administrados con la cena), durante 45 días.
Portadores de Meningococos: Se recomienda administrar RIFADIN® 600 mg/12 h durante 2 días, o 600 mg/24 h durante 4 días consecutivos.
Portadores de H. influenzae: Para los cohabitantes del mismo núcleo familiar expuestos a H. influenzae B y que estén en contacto con niños de 4 años de edad o menores, se recomienda que todos los miembros (incluyendo los niños), reciban RIFADIN® a razón de 20 mg/kg/día en una sola toma (dosis diaria máxima 600 mg), durante 4 días los neonatos (≤ 1 mes) deben recibir 10 mg/kg/día durante 4 días.
Otras Infecciones: En caso de otras infecciones causadas por gérmenes sensibles a RIFADIN®, administrar 600-1,200 mg/día divididos en 2 ó 4 tomas.
Con el fin de prevenir la aparición de cepas mutantes resistentes, RIFADIN® debe administrarse siempre con otro agente antibacteriano con propiedades similares.
Niños:
Tuberculosis: RIFADIN® siempre debe ser administrada a razón de 10 a 20 mg/kg/día, sin exceder 600 mg/día, junto con por lo menos otro medicamento antituberculoso.
Portadores de Meningococos: No debe excederse de 600 mg/día.
Para niños mayores de 1 mes, la dosis recomendada es 10 mg/kg/12 h, durante 2 días ó 1 vez/día durante 4 días consecutivos.
Para niños menores de 1 mes la dosis recomendada es 5 mg/kg/12 h, durante 2 días ó 1 vez/día durante 4 días consecutivos.
Portadores de H. influenzae: Para los cohabitantes del mismo núcleo familiar expuestos a H. influenzae B y que estén en contacto con niños de 4 años de edad o menores, se recomienda que todos los miembros (incluyendo los niños) reciban RIFADIN® a razón de 20 mg/kg/día en una sola toma (dosis diaria máxima 600 mg) durante 4 días; los neonatos (≤ 1 mes) deben recibir 10 mg/kg/día durante 4 días.
MANIFESTACIONES Y MANEJO DE LA SOBREDOSIFICACIÓN O INGESTA ACCIDENTAL:
Signos y síntomas: Una sobredosificación se puede manifestar por náuseas, vómito, dolor abdominal, prurito, dolor de cabeza y letargia creciente, probablemente poco tiempo después de la ingestión aguda; puede ocurrir pérdida de conocimiento cuando existe daño hepático grave. Se puede presentar aumento transitorio de las enzimas hepáticas y/o bilirrubina, coloración naranja o marrón rojiza de la piel, orina, sudor, saliva, lágrimas y heces, cuya intensidad será proporcional a la cantidad ingerida. También se observó edema facial o periorbital en pacientes pediátricos. En algunos casos fatales se reportó hipotensión, taquicardia sinusal, arritmias ventriculares, convulsiones y paro cardiaco.
La dosis tóxica o letal aguda mínima no están bien determinada. Sin embargo, se han observado sobredosis agudas, no fatales, en adultos con dosis entre 9 y 12 g de rifampicina. Se han reportado sobredosis agudas fatales en adultos con dosis entre 14 y 60 g. En algunos casos tanto fatales como no fatales, estuvo involucrado el consumo de alcohol o existían antecedentes de abuso de alcohol.
Se han informado sobredosis no fatales de 100 mg/kg en una o dos dosis, en pacientes pediátricos de entre 1 a 4 años de edad.
Manejo: Se deben iniciar medidas de soporte intensivo, y los síntomas individuales deben tratarse conforme vayan surgiendo. Como es probable que se presenten náuseas y vómito, el lavado gástrico es preferible a la inducción de emesis. Después de la evacuación del contenido gástrico, la instilación de una mezcla con carbón activado al estómago puede ayudar en la absorción de cualquier resto de fármaco en el tracto gastrointestinal. Para el control de las náuseas y el vómito severos pueden ser necesarios medicamentos antieméticos. Una diuresis activa (con ingestión y evacuación medidas) ayudará a la excreción del medicamento. La hemodiálisis puede ser de valor para algunos pacientes.
PRESENTACIONES: Caja con 16 y 20 cápsulas de 300 mg en envase de burbuja.
RECOMENDACIONES SOBRE ALMACENAMIENTO: Consérvese a temperatura ambiente a no más de 30°C y en lugar seco.
LEYENDAS DE PROTECCIÓN:
Literatura exclusiva para médicos. Su venta requiere receta médica. No se deje al alcance de los niños. ANTIBIÓTICO. El uso incorrecto de este producto puede causar resistencia.bacteriana.
Reporte las sospechas de reacción adversa al correo:
farmacovigilancia@cofepris.gob.mx
SANOFI-AVENTIS DE MÉXICO, S.A. de C.V.
Acueducto del Alto Lerma No. 2
Zona Industrial Ocoyoacac
C.P. 52740, Ocoyoacac, México
Reg. Núm. 69441, SSA IV
® Marca registrada